
| A. | 22.4L氢气中含有氢分子数目为NA | |
| B. | 常温常压下,14g氮气含有的原子数目为NA | |
| C. | 0.5mol Na2CO3中含有的Na+数目为0.5NA | |
| D. | 0.5mol/L Fe2(SO4)3溶液中,SO42-的数目为1.5NA |
科目:高中化学 来源: 题型:选择题
| A. | 属于溶液 | B. | 能产生丁达尔效应 | ||
| C. | 分散质粒子能透过滤纸 | D. | 纳米碳粒子能够发生布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
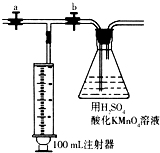 已知常温下甲醛(HCHO)是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛(HCHO)是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ②④⑤ | C. | ①③⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ③④⑤⑥ | C. | ②④⑤⑥ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | |
| B. | Na2O+H2O=2NaOH | |
| C. | Na2CO3+H2SO4=Na2SO4+CO2↑+H2O | |
| D. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
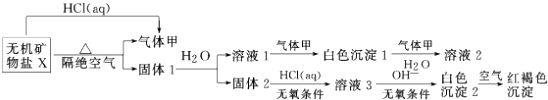
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com