
| 1 |
| 2 |
| 1 |
| 2 |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 | ||
B、室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中
| ||
| C、室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1mol/L的NaF溶液与0.1mol/L的CH3COOK溶液相比,一定有c(Na+)-c(F-)<c(K+)-c(CH3COO-)成立 | ||
D、在25℃时,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3?H2O的电离常数Kb=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
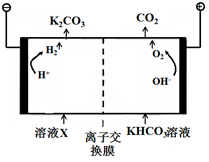 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
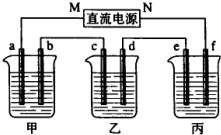 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、AgNO3 |
| C、KI |
| D、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③ |
| B、相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③ |
| C、常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度大小顺序为:c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-) |
| D、常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离出来的c(H+)=1.0×10-13mo1/L |
| B、c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| C、与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) |
| D、与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)=0.1mo1/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同物质的量浓度的①CH3COONa溶液②NaNO3溶液③NH4Cl溶液④NaOH溶液,pH的大小顺序是:④>①>②>③ |
| B、在Na2SO3和NaHSO3混合液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C、相同条件下,pH=10的CH3COONa溶液和氨水中,由水电离出的c(OH-)前者大于后者 |
| D、某溶液中只含Na+、CH3COO-、H+、OH-四种离子,则溶液一定呈现碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com