
分析 根据化学式改写成相应的氧化物的形式,按照活泼金属氧化物.较活泼金属氧化物.SiO2.H2O的顺序来书写,并要遵守原子守恒来分析解答;硅为+4价,氧为-2价,钙和镁均为+2价,氢为+1价,根据化合价判断氧化物的化学式,并检查原子个数确定化学式前的系数.
解答 解:nBeO.Al2O3.6SiO2,根据O原子守恒得,n+3+6×2=18,所以n=3;根据硅酸盐改写成氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•二氧化硅•水,同时要遵循原子守恒,Ca2Mg5Si8O22(OH)2可表示为:2CaO•5MgO•8SiO2•H2O;
故答案为:3;2CaO•5MgO•8SiO2•H2O.
点评 本题考查了将复杂化合物中原子个数的确定、复杂的硅酸盐改写成氧化物,题目难度不大,熟悉原子守恒的方法及硅酸盐用氧化物来表示的方法及化合价原则即可解答.


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
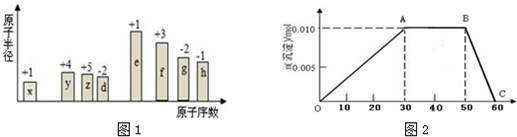
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
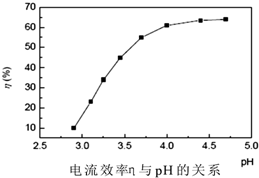 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸,沉淀不溶解,该溶液一定含有SO42- | |
| B. | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色,该溶液一定含有Fe2+ | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,该溶液一定含有CO32- | |
| D. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果滴定管尖嘴部分有气泡,应快速放液,把气泡赶走 | |
| B. | 物质溶解后,立即转移到容量瓶中 | |
| C. | 读滴定管液面读数时,应当平视,读取液体凹液面与刻度线相切处的读数,一般要求读到小数点后面一位 | |
| D. | 酸式滴定管滴液时左手拿锥形瓶,右手控制活塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com