
| A、在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
| B、在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO32- |
| C、在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2可以看成:KOH、Ba(OH)2、BaCO3、K2CO3 |
| D、在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、苯中含有苯酚(浓溴水,过滤) |
| B、乙酸钠中含有碳酸钠(乙酸,蒸发) |
| C、乙酸乙酯中含有乙酸(饱和碳酸钠溶液,分液) |
| D、溴乙烷中含有醇(水,分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
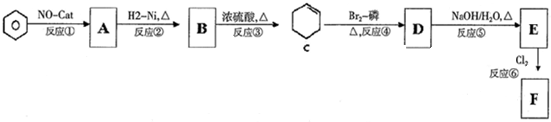
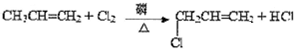 F的结构简式为
F的结构简式为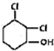
 直接制
直接制 ,理由是
,理由是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| B、第一电离能Y不一定小于X |
| C、X与Y形成化合物时,X显负价,Y显正价 |
| D、Y的气态氢化物的稳定性小于X气态氢化物的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
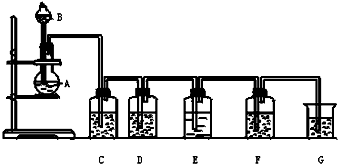 实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:
实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2,再加入 | |
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2,再加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
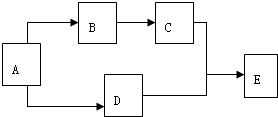 有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题:
有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2SiO3溶液中通入CO2产生白色胶状沉淀 |
| B、NaOH溶液不能存放在磨口玻璃塞的试剂瓶中 |
| C、二氧化硅溶于水生成硅酸 |
| D、二氧化硅是一种熔沸点很高、硬度很大的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤正确 | B、都不正确 |
| C、③④正确 | D、仅⑤正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com