
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.01 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的CH3COOH溶液 |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
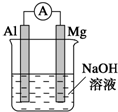 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )| A、①②⑦⑧ | B、③④⑤⑥ |
| C、①②⑥⑦ | D、②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
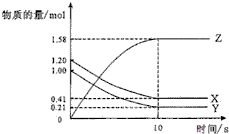 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )| A、达到平衡所需要的时间是10s |
| B、平衡时Y的转化率79.0% |
| C、该反应的化学方程式为X(g)+Y(g)?2Z(g) |
| D、前10s,用Z表示的反应速率为0.79mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
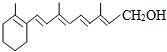 维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )
维生素A(见图)是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致夜盲症、皮肤干燥等多种病症.下列有关维生素A的认识不正确的是( )| A、维生素A的分子式为C18H28O |
| B、一定条件下,维生素A能被酸性KMnO4溶液氧化 |
| C、维生素A可使溴水褪色 |
| D、1mol维生素A分子最多可跟5 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑦① | B、②③⑦① |
| C、②⑤⑦① | D、④②⑥① |
查看答案和解析>>
科目:高中化学 来源: 题型:
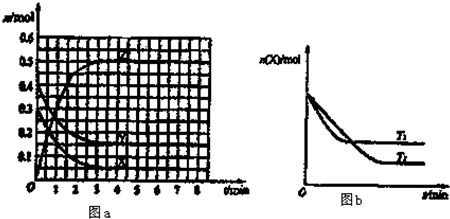
| A、该反应的正反应是吸热反应 |
| B、T0℃,从反应开始到平衡时:v(X)=0.083 mol?L-1?min-1 |
| C、图a中反应达到平衡时,Y的转化率为37.5% |
| D、T0℃在原平衡中再充入0.4molY(g)、0.3molX(g),则平衡正向移动,Z体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
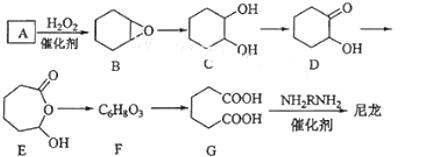
查看答案和解析>>
科目:高中化学 来源: 题型:
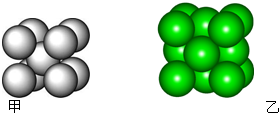 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.| 金属 | 相对原子质量 | 密度/g?cm-3 | 原子化热/kJ?mol-1 |
| Na | 22.99 | 0.960 | 108.4 |
| M | 60.20 | 7.407 | 7735 |
| 3 |
| 200 |
| 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com