
【题目】现用98%浓硫酸(密度1.84 g·cm3)配制浓度为0.5 mol·L1稀硫酸500mL.
(1)选用的主要仪器有:_________、________、__________、_______、
__________;
(2)请将下列操作按照正确的序号填在横线上___
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶体滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓硫酸
F.将溶液转入容量瓶
(3)所需浓硫酸的体积为______mL.
(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是______;若搅拌过程中有液体溅出,会使最终结果______(填偏高、偏低或无影响)。
【答案】量筒 烧杯玻璃棒500mL容量瓶胶头滴管AEFDCB13.6使稀释浓硫酸放出的热量迅速散去偏低
【解析】
(1)根据配制500mL 0.5mol/L稀硫酸的步骤可知,配制过程中使用的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;(2)配制500mL 0.5mol/L稀硫酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,所以正确的操作顺序为:AEFDCB;(3)500mL 0.5mol/L的稀硫酸中含有溶质硫酸的物质的量为:0.5mol/L×0.5L=0.25mol,设需要98%浓硫酸(密度1.84g/cm3)的浓硫酸的体积为VL:则![]() ,解得V≈0.0136L=13.6mL;(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,浓硫酸稀释过程放出大量的热量,需要通过玻璃棒的搅拌使稀释浓硫酸放出的热量迅速散去;若溶液部分溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低。
,解得V≈0.0136L=13.6mL;(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,浓硫酸稀释过程放出大量的热量,需要通过玻璃棒的搅拌使稀释浓硫酸放出的热量迅速散去;若溶液部分溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt 易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
A. ①③④⑤ B. ①④⑤ C. ③④⑤⑦ D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值下列有关叙述正确的是
A. 常温常压下, 30 g乙烷中所含的极性共价键数为6NA
B. 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
C. 0.1 mol![]() Sr原子中含中子数为3.8NA
Sr原子中含中子数为3.8NA
D. 0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是化工行业广泛应用的基础原料,某化学兴趣小组为探究浓硫酸所具有的一些特殊性质,进行如下有关实验。
实验一:浓硫酸与铜反应
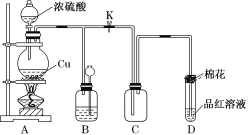
(1)装置A中发生反应的化学方程式为___________________________________;
当反应转移0.2mol电子时,生成气体在标况下的体积为____L,被还原的硫酸为____mol
(2)装置D中试管口放置的棉花浸有NaOH浓溶液,其作用是_________________;
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中由于气压增大引发的现象是________________,B中应放置的溶液是________。
A.水 B.酸性KMnO4溶液
C.浓溴水 D.饱和NaHSO3溶液
实验二:浓硫酸与碳反应,并验证反应生成的气体产物
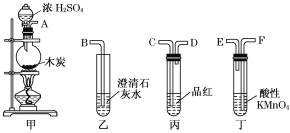
(4)冯同学认为按照甲、丙、丁、乙的装置顺序,即可验证产物为SO2和CO2,那么丁中酸性KMnO4溶液的作用是______________;
(5)陈同学认为丙装置要使用两次才能确保检验气体产物的准确性,如按该同学所说,气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A——________________________________________________________——B;
能说明气体产物中有CO2的实验现象是①__________________②____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NA表示阿伏加德罗常数的数值.46g NO2和N2O4的混合气体中含有_____NA个氧原子;2L0.6 mol·L1 Fe(NO3)3溶液中含_____NA个NO3—离子.
(2)三氟化氮(NF3)是一种气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式_________________________________
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2NF3+3NH4F;据题意推测NF3,F2,NO三种气体中,氧化性由强到弱的顺序为________________________
(3)H2C2O4溶液和KMnO4酸性溶液可发生反应:___H2C2O4+___MnO4﹣+___H+→___CO2↑+___Mn2++___H2O,反应中每生成标况下4.48L CO2气体,外电路中通过的电子的物质的量为___________mol.
(4)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2∶1,写出该反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既能与盐酸反应,又能与氢氧化钠溶液反应的化合物是( )
①Al(OH)3 ②Al2O3 ③Al ④NaHCO3 ⑤Mg(OH)2
A.①②③④B.①②③④⑤C.①②④D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细a-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程图如下:
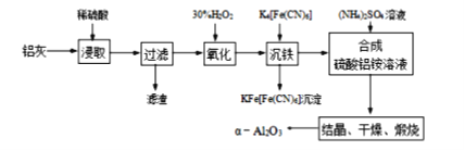
(1)铝灰中氧化铝与硫酸反应的化学方程式为_______。
(2)加30%的H2O2作用为将Fe2+氧化为Fe3+,其发生的离子反应方程式为__________。该反应需控制温度低于40℃,其目的是_____________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]=2Al2O3+2NH3↑+5SO3↑+3SO2↑+N2↑+53H2O,将产生的气体通过如图所示的装置。
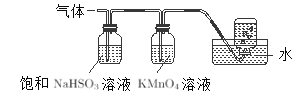
①足量饱和NaHSO3溶液吸收的物质除大部分H2O外还有________(填化学式)。集气瓶中收集到的气体是_______。
②KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为3B+2D![]() 6A+4C
6A+4C
B. 反应进行到6s时,各物质的反应速率相等
C. 反应进行到6s时,B的平均反应速率为0.1mol/(Ls)
D. 反应进行到1s时,v(A)![]() 3v(D)
3v(D)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com