

 .
.分析 L能使带火星的木条复燃,则L为O2,D、G、I是三种常见的化合物,J为化学工业中常用的强酸,其产量可以衡量一个国家化工业水平,则J为H2SO4,X为蓝色絮状沉淀化合物,则F与氢氧化钠反应得到,所以X为Cu(OH)2,F中含有铜离子,M与高锰酸钾反应得J,且M由浓硫酸与金属K反应得到,所以K为Cu,M为SO2,根据转化关系,F和C混合应为硫酸铜溶液,所以L为O2,C应为H2O,F为CuSO4,经测定D是由两种非金属元素组成的化合物,能使澄清的石灰水变浑浊,则D为CO2,E为Mg,二氧化碳与镁反应生成 氧化镁与碳,所以I为MgO,H为C,碳与二氧化碳反应生成 G为CO,根据B与J反应生成硫酸铜,则B为CuO,根据B、D、C的化学式可知,A为Cu2(OH)2CO3,据此答题.
解答 解:L能使带火星的木条复燃,则L为O2,D、G、I是三种常见的化合物,J为化学工业中常用的强酸,其产量可以衡量一个国家化工业水平,则J为H2SO4,X为蓝色絮状沉淀化合物,则F与氢氧化钠反应得到,所以X为Cu(OH)2,F中含有铜离子,M与高锰酸钾反应得J,且M由浓硫酸与金属K反应得到,所以K为Cu,M为SO2,根据转化关系,F和C混合应为硫酸铜溶液,所以L为O2,C应为H2O,F为CuSO4,经测定D是由两种非金属元素组成的化合物,能使澄清的石灰水变浑浊,则D为CO2,E为Mg,二氧化碳与镁反应生成 氧化镁与碳,所以I为MgO,H为C,碳与二氧化碳反应生成 G为CO,根据B与J反应生成硫酸铜,则B为CuO,根据B、D、C的化学式可知,A为Cu2(OH)2CO3,
(1)根据上面的分析可知,D为CO2,G为CO,L为O2,所以在D、G、I三种化合物中,一定含有L、H两种元素的化合物是D、G,
故答案为:D、G;
(2)D为CO2,D结构式是O=C=O,
故答案为:O=C=O;
(3)A为Cu2(OH)2CO3,A分解的化学反应方程式为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2 ↑,
故答案为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2 ↑;
(4)M为SO2,M与酸性高锰酸钾反应的离子方程式并标出电子转移方向和数目为  ,补充22.2gA即Cu2(OH)2CO3,其物质的量为0.1mol,即可使电解液恢复原浓度与体积,根据铜元素守恒可知,n[CuSO4]=0.2mol,所以则原溶液CuSO4的浓度是$\frac{0.2mol}{2L}$=0.1mol•L-1;假设电解过程中,控制电流与电压保持稳定,请在图2中画出阴阳两极产生的气体体积与时间的关系图.加入0.1molCu2(OH)2CO3即相当于加0.1molCu(OH)2和0.1molCuO,能使溶液恢复原状,阳极上氢氧根离子放电生成氧气,根据氧原子守恒得n(O2)=n[Cu(OH)2]+$\frac{1}{2}$CuO=0.15mol,则氧气体积=0.15mol×22.4L/mol=3.36L,电解池的阴极先是铜离子放电,铜离子总物质的量为0.2mol,此时阳极产生的氧气的物质的量为0.1mol,即体积为2.24L,铜离子放电结束后,阴极上是氢离子放电,根据氢元素守恒,n(H2)=n[Cu(OH)2]=0.1mol,产生的氢气的体积为2.24L,所以画出图为
,补充22.2gA即Cu2(OH)2CO3,其物质的量为0.1mol,即可使电解液恢复原浓度与体积,根据铜元素守恒可知,n[CuSO4]=0.2mol,所以则原溶液CuSO4的浓度是$\frac{0.2mol}{2L}$=0.1mol•L-1;假设电解过程中,控制电流与电压保持稳定,请在图2中画出阴阳两极产生的气体体积与时间的关系图.加入0.1molCu2(OH)2CO3即相当于加0.1molCu(OH)2和0.1molCuO,能使溶液恢复原状,阳极上氢氧根离子放电生成氧气,根据氧原子守恒得n(O2)=n[Cu(OH)2]+$\frac{1}{2}$CuO=0.15mol,则氧气体积=0.15mol×22.4L/mol=3.36L,电解池的阴极先是铜离子放电,铜离子总物质的量为0.2mol,此时阳极产生的氧气的物质的量为0.1mol,即体积为2.24L,铜离子放电结束后,阴极上是氢离子放电,根据氢元素守恒,n(H2)=n[Cu(OH)2]=0.1mol,产生的氢气的体积为2.24L,所以画出图为 ,
,
故答案为: ;0.1;
;0.1; .
.
点评 本题以钠及其化合物之间的转化为载体考查无机物推断,为高频考点,明确物质性质特殊性及物质之间的转化是解本题关键,注意以A的颜色、D的性质、B的状态为突破口进行推断,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
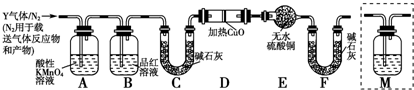
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙二醇互为同系物 | |
| B. | 异丙苯( )分子中碳原子可能都处于同一平面 )分子中碳原子可能都处于同一平面 | |
| C. | 按系统命名法,化合物( )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 | |
| D. |  的一溴代物和 的一溴代物和 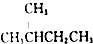 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用激光笔分别照射蛋白质溶液、硅酸溶胶 | 将二者区别开 |
| B | 将C2H5OH与浓H2SO4在蒸馏烧瓶中混合后加热至 170℃,烧瓶内逸出的物质通入到酸性KMnO4溶液中 | 检验有无乙烯生成 |
| C | 将Al(OH)3置于适量0.2mol•L-1 FeCl3溶液中,-段时间后可得到红褐色固体 | 溶度积:Ksp[AL(OH)3]>Ksp[Fe(OH)3] |
| D | 向蔗糖溶液中加入适量稀硫酸,水浴加热几分钟,然后加入新制的银氨溶液,并水浴加热 | 检验蔗糖的水解产物是否具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,25.5g NH3所含的原子数为6NA | |
| C. | 标准状况下,11.2L水所含的分子数为0.5NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| KClO3质量 | 1.2g | 1.2g | 1.2g |
| 其他物质质量 | 无其他物质 | CuO 0.5g | MnO2 0.5g |
| 待测数据 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com