

| 电离常数 酸 | K1 | K2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
分析 (1)①平衡常数随温度变化,温度不变,平衡常数不变;根据图象可知压强越大SO2(g)的平衡转化率(a)越大;
②根据图象可知c点在平衡点上方,所以要达到平衡要向下移动;
(2)①该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,负极上的物质失电子发生氧化反应,正极上的物质得电子发生还原反应,据此分析M极发生的电极反应式;
②根据Q=It和N=$\frac{Q}{e}$结合SO2-2e-+2H2O=4H++SO42-计算;
(3)将当通入448mL即$\frac{0.448}{22.4}$=0.02molSO2缓慢通入100mL 0.2mol•L-1即0.1×0.2=0.02mol的Na2CO3溶液中时,则按1:1反应书写离子方程式;当通入896mL即$\frac{0.896}{22.4}$=0.04molSO2时,则按2:1反应生成亚硫酸钠、水和二氧化碳,据此判断溶液中各离子浓度由大到小的顺序.
解答 解:(1)①平衡常数随温度变化,温度不变,平衡常数不变,所以K(a)=K(b),由图象可知压强越大SO2(g)的平衡转化率(a)越大,所以b点SO2(g)的平衡转化率比a点大,则SO2浓度c(a)>c(b),
故答案为:=;>;
②根据图象可知c点在平衡点上方,所以要达到平衡要向下移动即减小SO2(g)的平衡转化率即逆向移动,则v(正)<v(逆),
故答案为:<;
(2)①该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,通入氧气的N电极是正极,原电池放电时,氢离子由负极移向正极,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+=2H2O,负极M上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2-2e-+2H2O=4H++SO42-,
故答案为:SO2-2e-+2H2O=4H++SO42-;
②根据Q=It=2A×60s=120C,N=$\frac{Q}{e}$=$\frac{120}{1.6×1{0}^{-19}}$=7.5×1020个,
由SO2~~~~2e-
22.4 2×6.02×1023
V 7.5×1020
V=$\frac{22.4×7.5×1{0}^{20}}{2×6.02×1{0}^{23}}$≈0.014L,
故答案为:0.014;
(3)将当通入448mL即$\frac{0.448}{22.4}$=0.02molSO2缓慢通入100mL 0.2mol•L-1即0.1×0.2=0.02mol的Na2CO3溶液中时,则按1:1反应生成亚硫酸氢钠和碳酸氢钠,离子方程式为:SO2+H2O+CO32-=HCO3-+HSO3-;当通入896mL即$\frac{0.896}{22.4}$=0.04molSO2时,则按2:1反应生成亚硫酸钠、水和二氧化碳,则所得溶液即为亚硫酸钠溶液,电离大于水解显酸性,所以溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:SO2+H2O+CO32-=HCO3-+HSO3-;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题综合性较大,涉及化学平衡常数、化学平衡影响因素以及电化学知识等,为高考常见题型,侧重于学生的分析、计算能力的考查,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为
;元素e的电子排布式为1s22s22p63s23p5,c的离子结构示意图为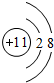
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中少量金属钠通常保存在煤油中 | |
| B. | 光线通过时,胶体可产生丁达尔效应 | |
| C. | 氧气、液氯是单质,氯水、氯化氢、纯碱是化合物. | |
| D. | “只要工夫深,铁杵磨成针”只涉及物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 等体积、浓度均为1 mol•L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为1:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4 OH-═2 Ba SO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com