
| A. | Fe2+、Na+、Cl-、NO3- | B. | Na+、Al3+、SO42-、Cl- | ||
| C. | NH4+、K+、NO3-、S2- | D. | Na+、K+、HCO3-、SiO32- |
分析 A.氯水具有强氧化性,能够氧化亚铁离子;
B.四种离子之间不发生反应,都不与氯水反应;
C.硫离子具有还原性,能够被氯水氧化;
D.碳酸氢根离子、硅酸根离子能够与氯水中的氢离子反应.
解答 解:A.Fe2+能够被氯水氧化,在氯水中不能大量共存,故A错误;
B.Na+、Al3+、SO42-、Cl-之间不发生反应,都不与氯水反应,在溶液中能够大量共存,故B正确;
C.氯水具有强氧化性,能够氧化S2-,在溶液中不能大量共存,故C错误;
D.HCO3-、SiO32-与硫酸中的氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:氯水中含有氯气、次氯酸和氯化氢,所以氯水具有强氧化性、酸性.


科目:高中化学 来源: 题型:解答题
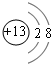 、
、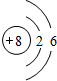 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属的用途 | 对应的金属物理性质 |
| 金可制成比纸还薄的金箔 | ③ |
| 用铁、铝等做炊具 | ② |
| 用铜制作印刷电路 | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.
;由A和B形成的原子个数为1:1的化合物中阴阳离子个数比为1:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平面三角形;平面三角形 | B. | 平面三角形;三角锥形 | ||
| C. | 三角锥形;平面三角形 | D. | 三角锥形;三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池工作时两极质量均增加 | |
| B. | Fe上镀Ag时,Ag接电源的正极 | |
| C. | 精炼铜时,阳极有0.2 molCu氧化阴极就有0.1 molCu2+被还原 | |
| D. | 用惰性电极电解饱和NaCl溶液和KNO3溶液,阴极都得到H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com