
| A.若X是原子晶体,Y是分子晶体,则熔点:X<Y |
| B.若A2+2D-═2A-+D2,则氧化性:D2>A2 |
| C.若R2-和M+的电子层结构相同,则原子序数:R<M,离子半径:R2-<M+ |
| D.若弱酸HA、HB的酸性HA>HB,则溶液的碱性NaA<NaB |
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:阅读理解
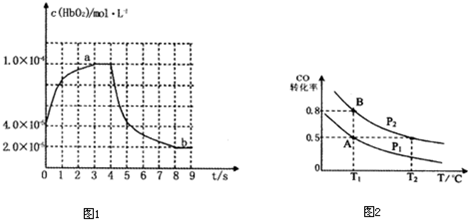
| 1 |
| 10000 |
| 1 |
| 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
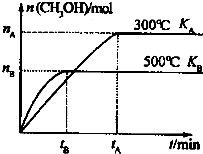 CO和H2与我们的生产和生活等方面密切相关.
CO和H2与我们的生产和生活等方面密切相关.| 1 |
| 2 |
| 1 |
| 2 |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源:广东省澄海中学2010-2011学年高一下学期期中考试化学试卷 题型:021
|
根据相关化学原理,下列判断一定正确的是 | |
A. |
含有共价键的化合物可能是离子化合物 |
B. |
A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
C. |
若R2-和M+的电子层结构相同,则R原子的核电荷数比M原子的小 |
D. |
常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(08赤峰二中模拟)根据相关化学原理,下列判断正确的是()
A.若A2+2D― = 2A―+D2 则氧化性:D2 >A2
B.若R2―和M+的电子层结构相同,则原子序数:R>M
C.若某非金属从游离态变成化合态,则该元素一定被还原
D.若弱酸HA的酸性强于弱酸 HB,则相同条件下,相同浓度钠盐溶液的碱性:NaA <NaB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com