
| A. | 用25 mL 碱式滴定管量取14.80 mL NaOH 溶液 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 用托盘天平称取 25.20 g NaCl晶体 | |
| D. | 用广范pH试纸测得某碱溶液的pH为12.7 |
分析 A.氢氧化钠溶液呈碱性,需要用碱式滴定管量取,且滴定管能够读到0.01mL;
B.量筒的最小读数为0.1mL;
C.托盘天平的最小读数为0.1g,无法称量25.20 g NaCl晶体;
D.广范pH试纸只能读出整数.
解答 解:A.滴定管的最小读数为0.01mL,可以用25 mL的碱式滴定管量取14.80 mL NaOH 溶液,故A正确;
B.10mL量筒的最小读数为0.1mL,无法用10 mL 量筒量取 7.50 mL 稀盐酸,故B错误;
C.托盘天平只能读到0.1g,无法用托盘天平称取 25.20 g NaCl晶体,故C错误;
D.广范pH试纸测定结果比较粗略,只能读出整数,无法用广范pH试纸测得某碱溶液的pH=12.7,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及滴定管、量筒、托盘天平及pH试纸的使用方法,明确常见仪器的构造及其准确度为解答关键,试题侧重基础知识的考查,有利于培养学生的分析、理解能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
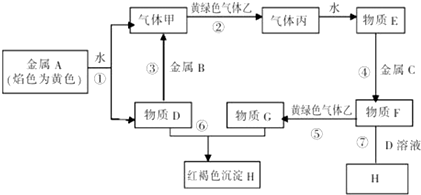
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑥ | C. | ③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水的反应Na+H2O=Na++OH-+H2↑ | |
| B. | 氯气通入水中Cl2+H2O=2H++Cl-+ClO- | |
| C. | 小苏打溶液中加入过量的石灰水Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 碳酸钙和醋酸CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H与D,16O与18O互为同位素:H216O、D216O、H218O、D218O互为同素异形体 | |
| B. | 元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y | |
| C. | 质量数相同的不同核素,一定属于不同种元素 | |
| D. | 含有共价键的物质是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com