
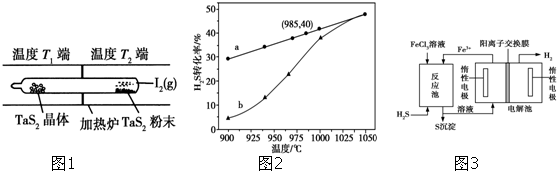
 �����廯����E2Z2ΪNa2O2��������E2QΪNa2S���������ƾ���ǿ�����ԡ������Ӿ��л�ԭ�ԣ����߷���������ԭ��Ӧ�������ʺ��������ƣ����ӷ���ʽΪNa2O2+S2-+2H2O=S+2Na++4OH-���ʴ�Ϊ��
�����廯����E2Z2ΪNa2O2��������E2QΪNa2S���������ƾ���ǿ�����ԡ������Ӿ��л�ԭ�ԣ����߷���������ԭ��Ӧ�������ʺ��������ƣ����ӷ���ʽΪNa2O2+S2-+2H2O=S+2Na++4OH-���ʴ�Ϊ�� ��Na2O2+S2-+2H2O=S+2Na++4OH-��
��Na2O2+S2-+2H2O=S+2Na++4OH-��| 1 |
| 2 |
| 1 |
| 8 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Һ̬�Ȼ��⡢��̬�Ȼ��Ʋ����磬����HCl��NaCl���ǵ���� |
| B��NH3��CO2ˮ��Һ���ܵ��磬����NH3��CO2���ǵ���� |
| C�����ǡ��ƾ���ˮ��Һ�л��ۻ�ʱ�����磬�������Dz��ǵ���� |
| D��ͭ��ʯī�����磬���������ǵ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��NaF�ĵ���ʽ[��
| ||||
| B���Ҵ��Ľṹ��ʽC2H6O | ||||
C������ԭ�ӽṹʾ��ͼ | ||||
| D������ĵ��뷽��ʽH2SO4�TH22++SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ж����߿ɾ���ʹ���մ���Һϴθ���漴��кʹBa2+ת��ΪBaCO3���ų� |
| B����ҵ�Ͽ�����NaHS����NH4��2S�ȿ�������������������ȥ��ˮ�е�Hg2+ |
| C��ˮ�е�Mg��HCO3��2��Ca��HCO3��2�����ֽ����������Ե�MgCO3��CaCO3����ˮ������Ҫ�ɷ���MgCO3��CaCO3 |
| D��ɺ�������Χ��ˮ�л�ȡCa2+��HCO3-������Ӧ�γ�ʯ��ʯ��CaCO3����ǣ��Ӷ����γ�ɺ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ȶ��ԣ�NaHCO3��Na2CO3 |
| B����ͬŨ����Һ�ļ��ԣ�Na2CO3��NaHCO3 |
| C���������ᷴӦ�ų�CO2�������ҳ̶ȣ�NaHCO3��Na2CO3 |
| D��Na2CO3����ת����NaHCO3����NaHCO3��ת����Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� �� | 1 | 2 | 3 | 4 |
| ����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����x=0.2��������Һ��y���ܴ���7��С��7 |
| B����x=0.2��y=1��������Һ�У�c��H+��=c��A2-��+c��OH-�� |
| C����x=0.3��y��7��������Һ�У�c��Na+����c��A2-����c��HA-����c��OH-����c��H+�� |
| D����x=0.4��������Һ�У�[c��Na+��+c��H+��]��2c��A2-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com