
【题目】将 1molCO和 2molH2充入一容积为 1L的密闭容器中,分别在250°C、T°C下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。根据图,下列分析中正确的是( )
CH3OH(g)。根据图,下列分析中正确的是( )
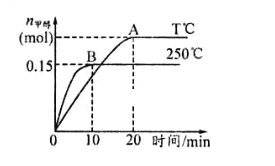
A.平衡时CO的转化率:250°C>T°C
B.该反应的正反应是放热反应
C.反应达平衡后,其他条件不变,若减小容积体积,CO 体积分数增大
D.250°C时,反应在前10s的平均速率υ(H2)=0.015mol/(L·min)
科目:高中化学 来源: 题型:
【题目】如下图所示操作能实现实验目的的是( )

A. 用图甲装置分离碘和四氯化碳,在锥形瓶中收集到碘单质
B. 用图乙装置收集NO气体
C. 用图丙装置验证牺牲阳极的阴极保护法
D. 用图丁装置测定待测液中I2的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2![]() ,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和
,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和![]() 。其一种生产工艺如下。
。其一种生产工艺如下。
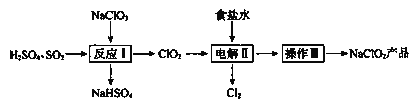
请回答下列问题:
(1)NaClO2中![]() 的化合价为_____________。
的化合价为_____________。
(2)反应I:
①![]() 做___________(填“氧化剂”或“还原剂”)。
做___________(填“氧化剂”或“还原剂”)。
②将反应I中的化学方程式补充完整:
![]() _____________
_____________
(3)电解II:
①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的![]() 和
和![]() ,需要加入的试剂分别为_______、___________。
,需要加入的试剂分别为_______、___________。
②电解过程中被氧化的物质是________。
③可用![]() 溶液吸收电解产生的
溶液吸收电解产生的![]() ,该反应的离子方程式是______________。
,该反应的离子方程式是______________。
(4)操作III:
滤液获利NaClO2的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】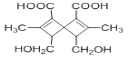 是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
A.该有机物在一定条件下能发生酯化反应、还原反应、氧化反应、加成反应、消去反应
B.该有机物中有4种官能团
C.1mol该有机物分别与足量的碳酸氢钠溶液、金属钠反应,产生气体的物质的量不相同
D.该有机物的分子式为C14H16O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌( ZnMn2O4)为电极材料,研制出一种水系锌离子电池,该电池的总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4(0<x<1)。下列说法正确的是( )
ZnMn2O4(0<x<1)。下列说法正确的是( )
A.放电时,Zn2+向负极迁移
B.充、放电过程中,仅锌元素的价态发生变化
C.充电时,阳极的电极反应式为ZnMn2O4 -2xe-=Zn1-XMn2O4+xZn2+
D.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20 g (已知F =96500 C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 计算:
计算:
(1)该条件下N2的平衡转化率______;(小数点后保留一位)
(2)该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数_______。(不带单位)
N2(g)+3H2(g)的平衡常数_______。(不带单位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol/L的NaOH溶液,分别滴定20mL、浓度均为0.1mol/L的两种酸HX、HY。所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
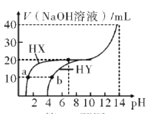
A.0.1mol/L的一元酸HY在水中有1%发生电离
B.a点的导电能力比b点弱
C.b点溶液中,c(HY)+2c(H+)=c(Y-)+2c(OH-)
D.加NaOH溶液至pH=7时,两种溶液中,(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
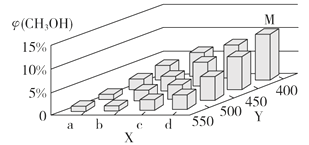
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法不正确的是( )
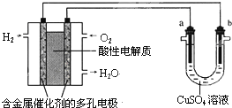
A.燃料电池工作时,正极反应为O2+4H++4e﹣=2H2O
B.a极是铜,b极是铁时,可实现铁上镀铜
C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出的铜质量相等
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com