
|
要证明某溶液中不含Fe3+而可能含有Fe2+.进行如下实验操作时最佳顺序为 ①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液 | |
| [ ] | |
A. |
①③ |
B. |
③② |
C. |
③① |
D. |
①②③ |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:阅读理解
| 7cV |
| 125a |
| 7cV |
| 125a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
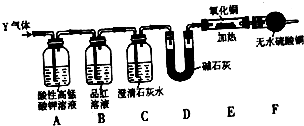
 某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com