
| A. | 元素的电负性:Na>P>Cl | |
| B. | 某元素(R)气态基态原子的逐级电离能分别为738、1451、7733、10540、13630,当它与氯气反应时可能生成的阳离子是R2+ | |
| C. | 具有下列电子排布式的原子中,①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是④ | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性就越强 |
分析 A.得电子能力越强,电负性越大;
B.该元素第三电离能剧增,最外层应有2个电子,表现+2价;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D.根据简单阴离子还原性越强与非金属性及最高价氧化物对应水化物的酸性的关系分析.
解答 解:A.得电子能力Na<P<Cl,所以元素的电负性Na<P<Cl,故A错误;
B.该元素第三电离能剧增,最外层应有2个电子,表现+2价,当它与氯气反应时最可能生成的阳离子是R2+,故B正确;
C.核外电子排布:①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,则①为Si、②为N、③为C、④为S,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Si>C>N,Si>S,故Si原子半径最大,即①的原子半径最大,故C错误;
D.ⅦA族元素的简单阴离子还原性越强,则对应的非金属性越弱,其最高价氧化物对应水化物的酸性就越弱,故D错误;
故选B.
点评 本题考查电负性、核外电子排布、微粒半径比较、元素的金属性、非金属性等,题目难度不大,注意元素的金属性、非金属性与元素性质的递变规律,侧重原子结构及性质的考查.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质中只含一种元素,所以只含一种元素的物质一定是单质 | |
| B. | 化学变化前后物质的质量总和不变,所以1g H2和1g O2一定能够生成2g H2O | |
| C. | 碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的物质一定呈碱性 | |
| D. | 中和反应有盐和水生成,所以有盐和水生的反应一定是中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

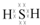 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、K+、OH-、CO32- | B. | H+、Ba2+、SO32-、Br - | ||
| C. | K+、Na+、Cl-、MnO4- | D. | Ca2+、Na+、HCO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1 mol/L NaHCO3溶液中含有HCO3-数目为0.1NA | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 1 mol Fe与足量稀HNO3反应,转移电子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com