
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;分析 由元素在周期表中位置,知①为C、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar.
(1)稀有气体化学性质最不活泼;同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,非金属性越强单质越活泼;元素④对应的离子为F-,核外有2个电子层,各层电子数为2、8;元素①的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对;
(2)同周期自左而右原子半径减小;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(4)元素③与⑦形成物质为二氧化硅,氧原子与Si原子之间形成共价键,属于原子晶体.
解答 解:由元素在周期表中位置,知①为C、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar.
(1)稀有气体Ar最外层为稳定结构,化学性质最不活泼;同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中Na的金属性最强,F元素非金属性最强,F2最活泼;元素④对应的离子为F-,离子结构示意图为 ,元素①的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对,电子式为
,元素①的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ,
,
故答案为:Ar;钠;F2; ;
; ;
;
(2)同周期自左而右原子半径减小,给出的第二周期的几种元素中,原子半径最大的是C,故答案为:C;
(3)金属性Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性更强;氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:NaOH;Al(OH)3+OH-═AlO2-+2H2O;
(4)元素③与⑦形成物质为二氧化硅,氧原子与Si原子之间形成共价键,属于原子晶体,故答案为:共价;原子.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,侧重对基础知识的巩固,注意对元素周期律的灵活掌握.


科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:X对应的强于Y对应的 | |
| B. | 气态氢化物的稳定性:HmX强于HnY | |
| C. | 第一电离能可能Y大于X | |
| D. | X与Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
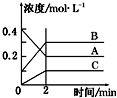
| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热△H=-192.9 kJ•mol-1 | |
| B. |  ②中的能量变化如图所示,则△H2=E1-E3 ②中的能量变化如图所示,则△H2=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下二者都可用铁制容器贮存 | B. | 常温下二者都能与铜较快反应 | ||
| C. | 露置于空气中,溶液浓度均降低 | D. | 浓HNO3与浓H2SO4都具有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com