
在﹣50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)⇌N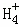 +N
+N ,N
,N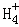 的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
|
| A. | 在液氨中加入NaNH2,可使液氨的离子积变大 |
|
| B. | 在液氨中加入NH4Cl,液氨的离子积不变 |
|
| C. | 此温度下液氨的离子积K为1×10﹣30 |
|
| D. | 在液氨中加入金属钠可能有NaNH2生成 |
| 弱电解质在水溶液中的电离平衡. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | 液氨的离子积K=c(NH4+).c(NH2﹣),向液氨中加入含有NH4+或NH2﹣的物质,能抑制液氨电离,液氨的离子积常数只与温度有关,根据钠和水的反应类比钠和液氨的反应. |
| 解答: | 解:A、虽然加入NaNH2可使平衡向逆反应方向移动,NH2﹣的浓度增大,但由水的离子积可知,其大小只与温度有关,与离子浓度无关,故A错误; B、虽然加入NH4Cl可使平衡向逆反应方向移动,NH4+的浓度增大,但由水的离子积可知,其大小只与温度有关,与离子浓度无关,故B正确; C、由电离方程式知,NH4+与NH2﹣的离子平衡浓度相等都为1×10﹣15mol/L,根据水的离子积得液氨的离子积为K=c(NH2﹣)c(NH4+)=1×10﹣30,故C正确; D、由钠与水反应可推知,2Na+2NH3=2NaNH2+H2↑,故D正确; 故选A. |
| 点评: | 本题考查对水的离子积理解与知识迁移能力,由水的离子积类比分析判断液氨的离子积,难度不大. |


科目:高中化学 来源: 题型:
下面有关丙烷、丙烯、丙炔说法中正确的是
A.如图,丙烷、丙烯、丙炔的结构分别表示为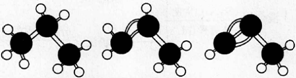
B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3 : 2 : 1
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相同条件下密度逐渐增大
D.丙炔的碳原予空间结构呈线性排列
查看答案和解析>>
科目:高中化学 来源: 题型:
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)⇌2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图.下列说法正确的是( )
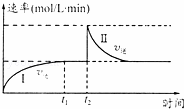
|
| A. | 0~t2时,v正>v逆 |
|
| B. | t2时刻改变的条件可能是加催化剂 |
|
| C. | Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ |
|
| D. | Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
为解决能源危机,在汽油中掺入一定比例的乙醇(即“乙醇汽油”),以代替一部分汽油.乙醇在气缸中完全燃烧的热化学方程式为: C2H5OH(l)+
C2H5OH(l)+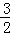 O2(g)=CO2(g)+
O2(g)=CO2(g)+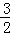 H2O(l)△H1=﹣683.4kJ/mol.下列说法正确的是( )
H2O(l)△H1=﹣683.4kJ/mol.下列说法正确的是( )
|
| A. | 该反应过程中,断裂化学键会放出热量 |
|
| B. | 该反应中,生成物的总能量大于反应物的总能量 |
|
| C. | 乙醇的燃烧热为683.4 kJ/mol |
|
| D. | 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为: .
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)⇌CH3OH(g)△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 .
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 .
a.高温高压 b.低温低压 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L﹣1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是( )
A.X=Y=Z B.X>Y=Z
C.X<Y=Z D.X=Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
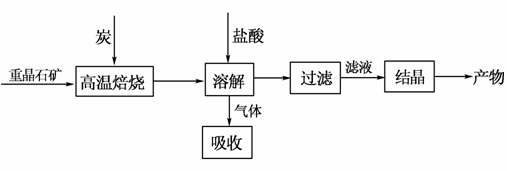
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s)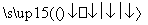 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)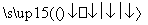 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=+226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________________________________________________。
(2)反应C(s)+CO2(g)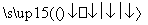 2CO(g)的ΔH=________kJ·mol-1。
2CO(g)的ΔH=________kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。
请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式______________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物的化学式分别是________,其中最不稳定的是________。
(3)它们的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的化学式________,电子式________,结构式________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com