
分析 纯水存在电离平衡,电离出的氢离子和氢氧根离子浓度相同,水的电离时吸热过程,常温下水电离出氢离子浓度为10-7mol/L;依据计算得到离子积常数为4.0×10-14,结合离子积常数计算得到溶液中氢氧根离子浓度,水电离出的氢氧根离子和氢离子浓度相同,以此解答该题.
解答 解:某温度下,纯水中的c(H+)=2.0×10-7mol•L-1,H2O?OH-+H+,常温下水电离出的离子浓度c(OH-)=c(H+),则c(OH-)=c(H+)=2.0×10-7mol•L-1,
若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol•L-1,Kw=c(OH-)×c(H+)=4.0×10-14(mol•L-1)2,c(OH-)=$\frac{4×1{0}^{-14}}{5×1{0}^{-4}}$=8.0×10-11 mol/L,
故答案为:2.0×10-7mol/L;8×10-11mol/L.
点评 本题考查了水的离子积常数、水电离平衡分析判断,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握水的电离特点,题目较简单.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据“溶液中的离子平衡”相关化学知识,回答下列问题.
依据“溶液中的离子平衡”相关化学知识,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$ | ||
| C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$ | D. | c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁与氢氧化钠反应:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O | |
| B. | 溴化亚铁溶液中通入过量的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 碳酸钙中滴入醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和
 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
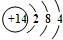 ;由①、④、⑥三种元素组成的化合物,其电子式是
;由①、④、⑥三种元素组成的化合物,其电子式是 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com