
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A溶液、B溶液、C溶液、D溶液进行实验。实验过程和记录如图所示(无关物质已经略去):
请回答:
(1)Y、Z的化学式分别为:Y________;Z__________。
X与B反应的离子方程式为_________________________________________________。
(2)D溶液pH________7(填“大于”“小于”或“等于”),原因是(用离子方程式表示)______________________________
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是__________________。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式________________________________
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是___________________________
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是:
| A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1 |
| B.1mol/L NH4Cl溶液中 C(NH4+) = C(Cl-) |
| C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中C (Na+) =" C" (CH3COO-) |
| D.硫化钠溶液中,C (Na+) =" 2" C (S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
(1)通过________可以检验流程中滤液2中含有Na+。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO32- )=0.50 mol/L,c(HCO3- )=1×10-2 mol/L,则c(Na+)∶c(OH-)=________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42- ,另含有Fe2+、Cu2+等杂质。先加入________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 |  =4.3×10-7 =4.3×10-7 | 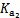 =5.6×10-11 =5.6×10-11 | Ka=3.0×10-8 |

 = 。
= 。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO 、H+、CO
、H+、CO 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。
(2)常温下,物质的量浓度均为0.1 mol·L-1的六种溶液①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为____________。
(3)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________________________
实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的________(填写物质的名称),把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(4)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(NH )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.010 mol·L-1硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水的电离平衡曲线如图所示:
若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下: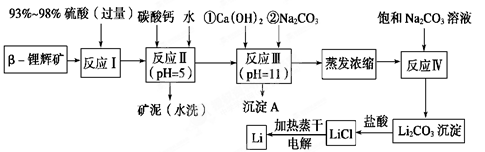
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com