
现有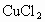 和
和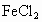 的混合溶液400mL,经测定
的混合溶液400mL,经测定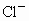 的浓度为
的浓度为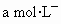 投入过量Zn bg,充分反应后过滤,得固体残渣洗涤干燥后质量为cg.试求:
投入过量Zn bg,充分反应后过滤,得固体残渣洗涤干燥后质量为cg.试求:
(1)混合液中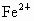 、
、 的物质的量浓度?
的物质的量浓度?
(2)b的数值范围_________
(3)c的数值越大说明混合液中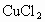 含量_______c的最大值应为__________(用a、b、c表示).
含量_______c的最大值应为__________(用a、b、c表示).
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.40 mL
B.72 mL
C.80 mL
D.128 mL
查看答案和解析>>
科目:高中化学 来源: 题型:013
已知使![]() 沉淀出来的pH小于使
沉淀出来的pH小于使![]() 沉淀出来的pH,现有200mL
沉淀出来的pH,现有200mL![]() 和
和![]() 的混合溶液,其中c(
的混合溶液,其中c(![]() )为0.2 mol·
)为0.2 mol·![]() .c(
.c(![]() )为1.3 mol·
)为1.3 mol·![]() ,要使其中
,要使其中![]() 转化为沉淀分离出来,至少需加入4 mol·
转化为沉淀分离出来,至少需加入4 mol·![]() 的NaOH溶液( )
的NaOH溶液( )
A.40 mL
B.72 mL
C.80 mL
D.128 mL
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.40 mL
B.72 mL
C.80 mL
D.128 mL
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三上学期期中考试理综化学试卷(解析版) 题型:填空题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
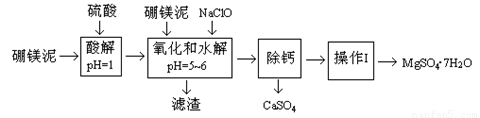
根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施__________、______________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是 。在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作 。
(5)已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤 、 。
(6)现有l.60 t硼镁泥,生产MgSO4·7H2O,若生产过程的产率为50%,则能生产出MgSO4·7H2O产品 t (计算结果保留三位有效数字)。(H:1 O:16 Mg:24 S:32)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com