
A.m=8-n B.m=9-n C.m=10-n D.m=12-n
科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源:河北省冀州中学2010-2011学年高一下学期期末考试化学理科试题(A卷) 题型:022
依据事实,填空:
(1)在25℃、101 kPa下,1 g甲醇液体完全燃烧生成CO2和液态水时放热22.68 kJ.则表示甲醇燃烧热的热化学方程式为________
(2)已知拆开1 mol H-H键,1 mol N-H键,1 molN≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________
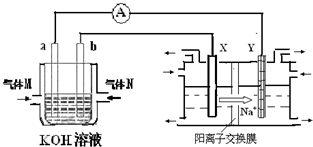
(3)氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极:________;负极:________
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

该反应的反应方程式可表示为________,平衡时Y气体的转化率________.
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1 mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来.则X的质量数为________;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量________.
查看答案和解析>>
科目:高中化学 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:022
据报道,我国拥有完全自主产权的氢氧燃料电池已在奥运会期间为运动员提供服务.燃料电池作为一种新型能源,由于其电极材料丰富,电解质多种多样(可以是固态、液态、气态等),将渗透到我们生活的各个领域.
(1)碱性燃料电池是采用30%~50%KOH溶液作电解质溶液,以H2为燃料在一定条件下使其发生反应,则该电池的正极电极反应式为________.工作一段时间后,电解液中溶液的pH将________(填“增大”、“减小”或“不变”)
(2)已知燃烧1 g氢气生成液态水放出热量143 kJ,某燃料电池以H2作燃料,写出该反应的热化学方程式__________________,氢氧燃料电池用于航天飞船,通过电极反应产生的水经冷凝后可供航天员饮用,当得到1.8 L饮用水时,电池内转移电子的物质的量约为________
A.1.8 mol
B.3.6 mol
C.100 mol
D.200 mol
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。
N2O4(g)的平衡常数K=___,若NO2的起始浓度为2 mol/L,且初始时无N2O4,其他条件保持不变,则NO2的最大转化率为___。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com