
【题目】(1)0.5 mol Na2CO3中含有___________个Na+。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是____________。
(3)配制90 mL 0.1 mol/L CuSO4溶液,需要胆矾________g。
(4)氧化还原反应3S+6KOH=2K2S+K2SO3+3H2O中,氧化剂与还原剂的物质的量之比为_____________,若反应中消耗了0.6molS,则反应中转移的电子为________mol。
(5)现有下列10种物质:①H2O、②Mg、③CH3COOH、④NaOH、⑤CuSO4·5H2O、⑥碘酒、⑦C2H5OH、⑧盐酸,(将序号填在相应的空格内)其中,属于强电解质的是_____________。
【答案】NA或6.02×1023 NH3 2.5 2:1 0.8 ④⑤
【解析】
(1)由化学式可知,钠离子的物质的量是碳酸钠的2倍,再根据N=nNA计算Na+的数目;
(2)四种气体的相对分子质量分别为36.5、17、44、32,由m=nM可知物质的量由大到小的顺序是NH3>O2>HCl>CO2。同温同压下,物质的量最大的就是体积最大的;
(3)配制90 mL 0.1 mol/L CuSO4溶液,实验室没有90 mL规格的容量瓶必须配制100mL,根据n=cV可知需要硫酸铜的物质的量;
(4) 在3S+6KOH=K2SO3+2K2S+3H2O反应中,S元素化合价分别由0价升高为+4价,被氧化,降低为-2价,被还原,反应中硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断;
(5)在水溶液中能完全电离的电解质属于强电解质。
(1)由化学式可知,钠离子的物质的量是碳酸钠的2倍,0.5 mol Na2CO3中n(Na+)=0.5mol×2=1mol,故Na+的数目为NA或6.02×1023;
(2)四种气体的相对分子质量分别为36.5、17、44、32,由m=nM可知质量都是50g的四种气体物质的量由大到小的顺序是NH3>O2>HCl>CO2;同温同压下,物质的量最大的就是体积最大的,所以气体体积最大的是NH3;
(3)配制90 mL 0.1 mol/L CuSO4溶液,实验室没有90 mL规格的容量瓶必须配制100mL,根据n=cV可知需要硫酸铜的物质的量是0.1L×0.1mol/L=0.01mol,则需要CuSO4·5H2O的质量是0.01mol×250g/mol=2.5g;
(4)在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知,氧化剂和还原剂的物质的量之比为2:1;
根据反应可知,若反应中消耗了0.6molS,则反应中转移的电子为![]() 0.8mol;
0.8mol;
(5) 在水溶液中能完全电离的电解质属于强电解质。①H2O部分电离 属于弱电解质、②Mg为单质既不是电解质也不是非电解质、③CH3COOH部分电离属于弱电解质、④NaOH在水溶液中完全电离属于强电解质、⑤CuSO4·5H2O在水溶液中完全电离属于强电解质、⑥碘酒为混合物既不是电解质也不是非电解质、⑦C2H5OH是在水溶液中和熔融状态下不能导电的化合物,属于非电解质、⑧盐酸是混合物既不是电解质也不是非电解质,故属于强电解质的是④⑤。


科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,也是重要的非金属元素。
回答下列问题:
(1)基态磷原子的价电子排布式为________________。
(2)N和P同主族且相邻,PF3和NH3都能与许多过渡金属形成配合物,但NF3却不能与过渡金属形成配合物,其原因是____________________________________________。
(3)磷酸为三元酸,其结构式为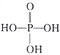 。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
(4)将磷酸加热可发生分子间脱水生成焦磷酸(H4P2O7)、三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是______________________________________________________。
(5)磷化硼(BP)是受到高度关注的耐磨涂料。BP中B和P原子均形成共价键,其中存在配位键,配位键中提供孤电子对的是____________(填元素符号)原子;磷化硼的晶体类型是____________,其中B原子的杂化方式是____________杂化,1molBP中含有____________molB-P键。
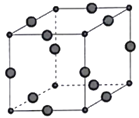
(6)Cu3P的晶胞结构如图所示,P3-的配位数为____________,Cu+的半径为apm,P3-的半径为bpm,阿伏加德罗常数的值为NA,则CuP晶体的密度为____________g·cm-3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38
Ksp[Mn(OH)2]=2.l×10-13
(1)原子序数为29的Cu的原子结构示意图为______________________。
(2)滤渣B的主要成分为___________________(填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式________________________________。
②若用浓HNO3溶解金属硫化物,缺点是_______________________(任写一条)。
(5)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于________。
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料,通过下图所示步骤能合成一种高分子涤纶G(转化过程中的部分反应条件及部分产物已略去):
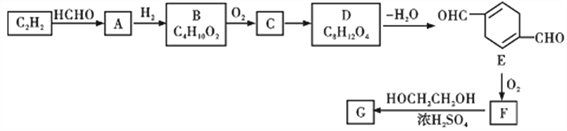
其中A、B、C、D分别代表一种有机物,B分子中无甲基。
己知:-C![]() CH+
CH+

请回答下列问题:
(1)A中含氧官能团名称为________,生成A的反应类型是__________,B的化学名称为__________________。
(2)B→C的化学反应方程式____________________。F和H2完全加成得到的物质的结构简式是_________。
(3)写出符合下列条件的E的同分异构体的结构简式_______________。
①含有苯环 ②属于酯类 ③可发生银镜反应 ④苯环上有两种不同环境的氢原子
(4)下列说法正确的是_______(填字母代号)
a.上述流程中,乙炔、有机物B、有机物E都可发生聚合反应
b.有机物E中所有原子共平面
c.35%~40%的甲醛(HCHO)溶液俗称福尔马林溶液,能使蛋白质变性
(5)请写出F生成G的化学方程式________________________。
(6)根据题给信息,写出用甲醛和乙醇为原料制备季戊四醇[C(CH2OH)4]的合成路线(其它试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的操作过程中,仪器选用不正确的是 ( )
选项 | A | B | C | D |
操作 | 称取3g左右的剪碎了的干海带 | 灼烧干海带碎片至完全变成灰烬 | 过滤煮沸后的海带灰与水的混合液 | 用四氯化碳从氧化后的海带灰浸取液中提取碘 |
选用仪器 | 托盘天平 | 蒸发皿 | 普通漏斗 | 分液漏斗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:

已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
(1)“预处理"时,需用Na2CO3调节溶被至微酸性而不是碱性,其原因是_____
(2)“还原Ⅰ”需在80℃条件下进行,适宜的加热方式为_______
(3)“还原Ⅱ”中,Cu2+参与反应的离子方程式为______
(4)“搅拌”时加入NaCl粉末的作用是________
(5)“过滤Ⅱ”得到的Cu2Cl2需用无水乙醇洗涤,并在真空干燥机内于70℃干燥2小时,冷却,密封包装。于70℃真空干燥的目的是_________
(6)①请设计从“过滤Ⅰ”所得滤渣中获取Cu的实验方案:_______(实验中可供选择的试剂:稀硫酸、稀硝酸、蒸馏水)。
②现欲测定途径a、b回收铜元素的回收率比,请补充实验方案:_______________,分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1g,Cu2Cl2的质量为m2g,则途径a、b铜素的回收率比为________(铜元素回收率=产品中铜元素质量/废液中铜元素的质量×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) △H1=a kJ/mol 平衡常数K1;
2CO(g) △H1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) △H2=b kJ/mol 平衡常数K2;
某反应的平衡常数表达式K3=![]() ,请写出此反应的热化学方程式:__________,K1、K2、K3之间的关系是:_____________。
,请写出此反应的热化学方程式:__________,K1、K2、K3之间的关系是:_____________。
(2)将原料气按n(CO2):n(H2)=1:4置于密闭容器中发生CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如图所示
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如图所示
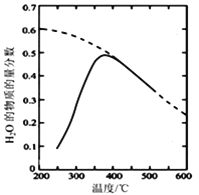 (虚线表示平衡曲线)。
(虚线表示平衡曲线)。
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是_____。
A.混合气体密度不再改变
B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变
D. n(CO2):n(H2)=1:2
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算表达式为______。(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)500℃时,CO与水反应生成CO2和H2。将CO2和H2分离得到H2的过程示意图如下。
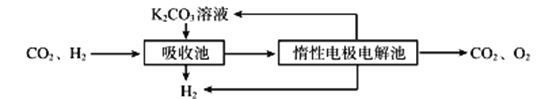
①吸收池中所有离子浓度的等式关系是____________________________。
②结合电极反应式,简述K2CO3溶液的再生原理:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com