
ΓΨΧβΡΩΓΩ“―÷Σ≥ΘΈ¬œ¬Θ§≈®Ε»ΨυΈΣ0.1 molΓΛLΘ≠1ΒΡ4÷÷ΡΤ―Έ»ή“ΚpH»γœ¬±μΘ§œ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «(ΓΓΓΓ)
»ή÷ | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 8.3 | 5.2 |
A. ΉψΝΩSO2Ά®»κNaClO»ή“Κ÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚH2OΘΪSO2ΘΪClOΘ≠===HClOΘΪHSO
B. œρ¬»Υ°÷–Φ”»κNaHCO3Θ§Ω…“‘‘ω¥σ¬»Υ°÷–¥Έ¬»ΥαΒΡ≈®Ε»
C. ≥ΘΈ¬œ¬Θ§œύΆ§Έο÷ ΒΡΝΩ≈®Ε»ΒΡH2SO3ΓΔH2CO3ΓΔHClO»ή“ΚΘ§pHΉν¥σΒΡ «H2SO3
D. NaHSO3»ή“Κ÷–άκΉ”≈®Ε»¥σ–ΓΥ≥–ρΈΣΘΚc(NaΘΪ)ΘΨc(HΘΪ)ΘΨc(HSO)ΘΨc(SO![]() )ΘΨc(OHΘ≠)
)ΘΨc(OHΘ≠)
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩ
ΗυΨί±μ÷–―ΈΒΡpHΘ§Ω…“‘»ΖΕ®»θάκΉ”ΒΡΥ°Ϋβ≥ΧΕ»ΘΚCO32- >ClO- >HCO3- >HSO3-Θ§Υυ“‘Υα–‘Υ≥–ρ «ΘΚHCO3-< HClO <H2CO3<H2SO3,“‘¥ΥΖ÷ΈωΫβ¥πΓΘ
A.¥Έ¬»ΥαΡήΫΪ―«ΝρΥα«βΗυάκΉ”―θΜ·Θ§Ι A¥μΈσΘΜ
B.―ΈΥαΚΆΧΦΥα«βΡΤΖ¥”Π…ζ≥…¬»Μ·ΡΤΚΆΕΰ―θΜ·ΧΦΘ§¥ΌΫχ¬»ΤχΚΆΥ°Ζ¥”ΠΘ§¥Έ¬»ΥαΚΆΧΦΥα«βΡΤ≤ΜΖ¥”ΠΘ§Υυ“‘ΒΦ÷¬»ή“Κ÷–¥Έ¬»Υα≈®Ε»‘ω¥σΘ§Ι B’ΐ»ΖΘΜ
C.ΥαΗυάκΉ”Υ°Ϋβ≥ΧΕ»‘Ϋ¥σΘ§‘ρΥαΒΡΥα–‘‘Ϋ»θΘ§ΥαΗυάκΉ”Υ°Ϋβ≥ΧΕ»¥σ–ΓΥ≥–ρ «ΘΚCO32- >ClO- >HCO3- >HSO3-Θ§‘ρΥαΒΡ«Ω»θΥ≥–ρ «HCO3-< HClO <H2CO3<H2SO3,Υυ“‘≥ΘΈ¬œ¬Θ§œύΆ§Έο÷ ΒΡΝΩ≈®Ε»ΒΡH2SO3ΓΔH2CO3ΓΔHClO»ή“ΚΘ§pHΉν¥σΒΡ «HClO»ή“ΚΘ§Ι C¥μΈσΘΜ
D.―«ΝρΥα«βΡΤ»ή“Κ≥ Υα–‘Θ§ΥΒΟςHSO3-Βγάκ≥ΧΕ»¥σ”ΎΥ°Ϋβ≥ΧΕ»Θ§Έό¬έΒγάκΜΙ «Υ°ΫβΒΡ≥ΧΕ»ΕΦΫœ–ΓΘ§Υυ“‘c(HΘΪ)<c(HSO)Θ§’ΐ»ΖΒΡάκΉ”≈®Ε»¥σ–ΓΥ≥–ρΈΣΘΚc(NaΘΪ)ΘΨc(HSO)ΘΨc(HΘΪ)ΘΨc(SO![]() )ΘΨc(OHΘ≠)Θ§Ι D¥μΈσΘΜ
)ΘΨc(OHΘ≠)Θ§Ι D¥μΈσΘΜ
Υυ“‘B―Γœν «’ΐ»ΖΒΡΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΘΚ2CO(g)+O2(g)=2CO2(g)ΠΛH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΠΛH=-226kJ/mol
O2(g)ΠΛH=-226kJ/mol
ΗυΨί“‘…œ»»Μ·―ßΖΫ≥Χ Ϋ≈–ΕœΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. COΒΡ»Φ…’»»ΈΣ283 kJ
B. »γΆΦΩ…±μ Ψ”…CO…ζ≥…CO2ΒΡΖ¥”ΠΙΐ≥ΧΚΆΡήΝΩΙΊœΒ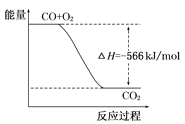
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΠΛHΘΨ-452 kJ/mol
D. CO(g)”κNa2O2(s)Ζ¥”ΠΖ≈≥ω509 kJ»»ΝΩ ±Θ§ΒγΉ”ΉΣ“Τ ΐΈΣ6.02ΓΝ1023
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑ―NaOHΓΔMgCl2ΓΔAlCl3»ΐ÷÷ΙΧΧεΉι≥…ΒΡΜλΚœΈο»ή”ΎΉψΝΩΒΡΥ°ΚσΘ§≤ζ…ζ1.16gΑΉ…Ϊ≥ΝΒμΓΘ‘ΌœρΥυΒΟ–ϋΉ«“Κ÷–÷πΒΈΦ”»κ1.00mol/L HCl»ή“ΚΘ§Φ”»κHCl»ή“ΚΒΡΧεΜΐ”κ…ζ≥…≥ΝΒμΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ ‘ΜΊ¥πΘΚ

Θ®1Θ©–¥≥ωAΒψΒΫBΒψΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ
Θ®2Θ©CΒψΦ”»κ―ΈΥα»ή“ΚΒΡΧεΜΐΈΣ ΓΘ
Θ®3Θ©‘≠ΜλΚœΈο÷–MgCl2ΒΡΈο÷ ΒΡΝΩ « Θ§NaOHΒΡ÷ ΝΩ « ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΖγΜ·ΚΆ≥±ΫβΖ÷±π________ΓΔ________Θ®ΧνΓΑΈοάμ±δΜ·Γ±ΜρΓΑΜ·―ß±δΜ·Γ±Θ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒγΜ·―ßΤχΟτ¥ΪΗ–ΤςΩ…”Ο”ΎΦύ≤βΜΖΨ≥÷–NH3ΒΡΚ§ΝΩ,ΤδΙΛΉς‘≠άμ»γΆΦΥυ Ψ,Τδ÷–NH3±Μ―θΜ·ΈΣ≥ΘΦϊΒΡΈόΕΨΈο÷ ΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «Θ® Θ©

A. »ή“Κ÷–OH-œρΒγΦΪa“ΤΕ·
B. ΒγΦΪb…œΖΔ…ζΜΙ‘≠Ζ¥”Π
C. ΗΚΦΪΒΡΒγΦΪΖ¥”ΠΈΣ2NH3-6e-+6OH-![]() N2+6H2O
N2+6H2O
D. άμ¬έΖ¥”ΠœϊΚΡΒΡNH3”κO2ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ3ΘΚ4
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥―ßœΑ–ΓΉι”ϊ¥”ΙΛ“ΒΖœΖΑ¥ΏΜ·ΦΝ÷–ΜΊ ’V2O5Θ§Ά®ΙΐΖ÷Έω÷ΣΗΟΖœΖΑ¥ΏΜ·ΦΝΒΡ÷ς“Σ≥…Ζ÷»γœ¬±μ:
Έο÷ | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
÷ ΝΩΖ÷ ΐ/% | 2.2ΓΪ29 | 2.8ΓΪ3.1 | 22ΓΪ28 | 60ΓΪ65 | 1ΓΪ2 | <1 |
ΥϊΟ«Ά®Ιΐ≤ι‘ΡΉ Νœ’“ΒΫ“Μ÷÷ΖœΖΑ¥ΏΜ·ΦΝΒΡΜΊ ’ΙΛ“’Νς≥Χ¬ΖœΏ»γœ¬:
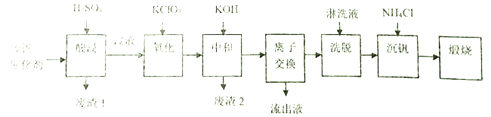
ΜΊ¥πœ¬Ν–Έ Χβ:
Θ®1Θ©ΓΑΥαΫΰΓ± ±V2O5ΉΣΜ·ΈΣVO2+Θ§V2O4ΉΣ≥…VO2+ΓΘ‘ρΓΑΖœ‘ϋ1Γ±ΒΡ÷ς“Σ≥…Ζ÷ «_____________ΓΘ
Θ®2Θ©ΓΑ―θΜ·Γ±ΒΡΡΩΒΡ « ΙVO2+±δΈΣVO2+Θ§–¥≥ωΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ________________________ΓΘ
Θ®3Θ©ΓΑ÷–ΚΆΓ±Ής”Ο÷°“Μ « ΙΖΑ“‘V4O124-–Έ Ϋ¥φ‘Ύ”Ύ»ή“Κ÷–Θ§‘ρΓΑΖœ‘ϋ2Γ±ΒΡ≥…Ζ÷”–__________(”ΟΜ·―ß Ϋ±μ Ψ)ΓΘ
Θ®4Θ©ΓΑάκΉ”ΫΜΜΜΓ±ΚΆΓΑœ¥Ά―Γ±Ω…ΦρΒΞ±μ ΨΈΣ:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROHΈΣèäΦν–‘“θάκΉ”ΫΜΜΜ ς÷§)ΓΘΓΑΝς≥ω“ΚΓ±÷–―τάκΉ”ΉνΕύΒΡ «_______________ΘΜΈΣΝΥΧαΗΏœ¥Ά―–߬ Θ§Νήœ¥“Κ”ΠΗΟ≥ ______–‘(ΧνΓΑΥαΓ±ΓΔΓΑΦνΓΑΜρΓΑ÷–Γ±)ΓΘ
R4V4O12+4OH-(ROHΈΣèäΦν–‘“θάκΉ”ΫΜΜΜ ς÷§)ΓΘΓΑΝς≥ω“ΚΓ±÷–―τάκΉ”ΉνΕύΒΡ «_______________ΘΜΈΣΝΥΧαΗΏœ¥Ά―–߬ Θ§Νήœ¥“Κ”ΠΗΟ≥ ______–‘(ΧνΓΑΥαΓ±ΓΔΓΑΦνΓΑΜρΓΑ÷–Γ±)ΓΘ
Θ®5Θ©ΓΑ≥ΝΖΑΓ±ΒΟΒΫΤΪΖΑΥαοß(NH4VO3)≥ΝΒμΘ§–¥≥ωΒΟΒΫ≥ΝΕ®ΒΡΜ·―ßΖΫ≥Χ Ϋ__________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΒΣΒΡ―θΜ·Έο(»γNO2ΓΔNO4ΓΔN2O5Β»)”Π”ΟΚήΙψΘ§‘Ύ“ΜΕ®ΧθΦΰœ¬Ω…“‘œύΜΞΉΣΜ·ΓΘ
(1) “―÷ΣΘΚ2NO(g)ΘΪO2(g)===2NO2(g)ΓΓΠΛH1
NO(g)ΘΪO3(g)===NO2(g)ΘΪO2(g)ΓΓΠΛH2
2NO2(g)![]() N2O4(g)ΓΓΠΛH3
N2O4(g)ΓΓΠΛH3
2N2O5(g)===4NO2(g)ΘΪO2(g)ΓΓΠΛH4
‘ρΖ¥”ΠN2O4(g)ΘΪO3(g)===N2O5(g)ΘΪO2(g)ΒΡΠΛHΘΫ__________ΓΘ
(2)¥”N2O5‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζΖ÷ΫβΘΚ2N2O5(g)===4NO2(g)ΘΪO2(g)ΓΘΡ≥Έ¬Ε»œ¬≤βΒΟΚψ»ίΟή±’»ίΤς÷–N2O5≈®Ε»Υφ ±ΦδΒΡ±δΜ·»γœ¬±μΘΚ
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/ (molΓΛLΘ≠1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
…ηΖ¥”ΠΩΣ Φ ±ΧεœΒ―Ι«ΩΈΣp0Θ§ΒΎ2.00 min ±ΧεœΒ―Ι«ΩΈΣpΘ§‘ρpΓΟp0ΘΫ________ΘΜ1.00ΓΪ3.00 minΡΎΘ§O2ΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ________ΓΘ
(3)N2O4”κNO2÷°Φδ¥φ‘ΎΖ¥”ΠN2O4(g)![]() 2NO2(g)ΓΘΫΪ“ΜΕ®ΝΩΒΡN2O4Ζ≈»κΚψ»ίΟή±’»ίΤς÷–Θ§≤βΒΟΤδΤΫΚβΉΣΜ·¬ [ΠΝ(N2O4)]ΥφΈ¬Ε»±δΜ·»γΆΦΥυ ΨΓΘ
2NO2(g)ΓΘΫΪ“ΜΕ®ΝΩΒΡN2O4Ζ≈»κΚψ»ίΟή±’»ίΤς÷–Θ§≤βΒΟΤδΤΫΚβΉΣΜ·¬ [ΠΝ(N2O4)]ΥφΈ¬Ε»±δΜ·»γΆΦΥυ ΨΓΘ

ΔΌΆΦ÷–aΒψΕ‘”ΠΈ¬Ε»œ¬Θ§“―÷ΣN2O4ΒΡΤπ Φ―Ι«Ωp0ΈΣ108 kPaΘ§Ν– ΫΦΤΥψΗΟΈ¬Ε»œ¬Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐKpΘΫ________(”ΟΤΫΚβΖ÷―Ι¥ζΧφΤΫΚβ≈®Ε»ΦΤΥψΘ§Ζ÷―ΙΘΫΉή―ΙΓΝΈο÷ ΒΡΝΩΖ÷ ΐ)ΓΘ
ΔΎ”…ΆΦΆΤ≤βN2O4(g)![]() 2NO2(g) «Έϋ»»Ζ¥”ΠΜΙ «Ζ≈»»Ζ¥”ΠΘ§ΥΒΟςάμ”…_______________Θ§»τ“ΣΧαΗΏN2O4ΉΣΜ·¬ Θ§≥ΐΗΡ±δΖ¥”ΠΈ¬Ε»ΆβΘ§ΤδΥϊ¥κ ©”–____________(“Σ«σ–¥≥ωΝΫΧθ)ΓΘ
2NO2(g) «Έϋ»»Ζ¥”ΠΜΙ «Ζ≈»»Ζ¥”ΠΘ§ΥΒΟςάμ”…_______________Θ§»τ“ΣΧαΗΏN2O4ΉΣΜ·¬ Θ§≥ΐΗΡ±δΖ¥”ΠΈ¬Ε»ΆβΘ§ΤδΥϊ¥κ ©”–____________(“Σ«σ–¥≥ωΝΫΧθ)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σ”–ΜζΈοA. B÷°Φδ¥φ‘ΎΉΣΜ·ΙΊœΒΘΚA(C6H12O2) +H2O![]() B+HCOOHΘ®“―≈δΤΫΘ©‘ρΖϊΚœΗΟΖ¥”ΠΧθΦΰΒΡ”–ΜζΈοB”–Θ®≤ΜΚ§ΝΔΧε“λΙΙΘ©
B+HCOOHΘ®“―≈δΤΫΘ©‘ρΖϊΚœΗΟΖ¥”ΠΧθΦΰΒΡ”–ΜζΈοB”–Θ®≤ΜΚ§ΝΔΧε“λΙΙΘ©
A. 6÷÷ B. 7÷÷ C. 8÷÷ D. 9÷÷
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΓΑ“ÓñυΓ± «“Μ÷÷Φ¥”ΟΦ¥άδΒΡ“ϊΝœΓΘΈϋ ≥ ±ΫΪ“ϊΝœΙόΗτάκ≤ψ÷–ΒΡΜ·―ßΈο÷ ΚΆΥ°ΜλΚœΚσ“ΓΕ·Φ¥Μα÷ΤάδΓΘΗΟΜ·―ßΈο÷ «
A.¬»Μ·ΡΤB.ΙΧΧεœθΥαΦΊC.…ζ ·Μ“D.ΙΧΧε«β―θΜ·ΡΤ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com