
| A. | 氘(2H)原子核内有1个质子 | |
| B. | 1H与2H是不同的核素 | |
| C. | 1H218O与2H216O的相对分子质量相同 | |
| D. | 1H2O与2H2O互为同位素 |
分析 A.根据核组成符合判断;
B.具有一定数目质子和一定数目中子的一种原子称为核素;
C.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20;
D.具有相同质子数,不同中子数的同一元素的不同核素互为同位素同位素.
解答 解:A.核组成符合左下方数字为质子数,故氘质子数为1,故A正确;
B.具有一定数目质子和一定数目中子的一种原子称为核素,1H与2H质子数相同,中子数不同,是氢元素的不同的核素,故B正确;
C.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,故C正确,
D.1H2O与2H2O为分子,不能称之为同位素,故D错误,
故选D.
点评 本题考查核素、同位素及质子数质子数和质量数关系,把握相关的概念及核变化为解答的关键,选项C为解答的易错点,注重基础知识的考查,题目难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
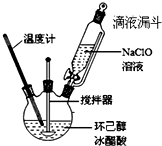 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.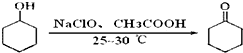
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| B. | Z位于元素周期表中第二周期,第ⅥA族 | |
| C. | X的气态氢化物的稳定性比Z的弱 | |
| D. | M的原子半径比Y的原子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
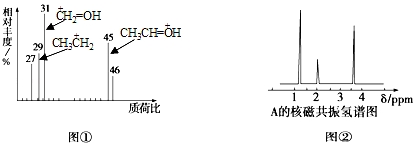
| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com