
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:

(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2) 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。

【答案】![]() p sp2 N>O>C O>N>C 3 平面正三角形
p sp2 N>O>C O>N>C 3 平面正三角形 ![]()
【解析】
(1)基态P原子的电子排布式为![]() ,P在元素周期表中位于p区;
,P在元素周期表中位于p区;
(2)尿素C原子上没有孤对电子,形成3个σ键,所以尿素分子中碳原子的杂化方式为sp2杂化,C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的;元素原子的得电子能力越强,则电负性越大;
(3)CO32-中C的价层电子对数=![]() 且不含孤电子对,根据价层电子对互斥理论判断空间结构;
且不含孤电子对,根据价层电子对互斥理论判断空间结构;
(4)晶胞密度计算时棱上计![]() ,角上计
,角上计![]() ,面上计
,面上计![]() ,内部计1。利用公式
,内部计1。利用公式![]() ,计算其密度。
,计算其密度。
(1)基态P原子的电子排布式为![]() ,P在元素周期表中位于p区;故答案为:
,P在元素周期表中位于p区;故答案为:![]() ;p;
;p;
(2)尿素C原子上没有孤对电子,形成3个σ键,所以尿素分子中碳原子的杂化方式为sp2杂化,C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,故第一电离能由大到小的顺序是N>O>C,元素原子的得电子能力越强,则电负性越大,电负性由大到小的顺序为O>N>C,故答案为:sp2;N>O>C;O>N>C;
(3)CO32-中C的价层电子对数=![]() 且不含孤电子对,空间构型为平面正三角形;故答案为:3;平面正三角形;
且不含孤电子对,空间构型为平面正三角形;故答案为:3;平面正三角形;
(4)由晶胞图可知,一个晶胞中含P原子数为![]() ,含钴原子数为
,含钴原子数为![]() ,所以一个晶胞质量为
,所以一个晶胞质量为![]() ;由图可知,由于相邻两个钴原子的距离为n pm,则立方体的棱长为
;由图可知,由于相邻两个钴原子的距离为n pm,则立方体的棱长为![]() n pm,则体积
n pm,则体积![]() ,密度
,密度![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】合成涤纶的流程图如下所示。

回答下列问题:
(1)A的名称为 ;
(2) F的结构简式是 ;
(3) C→D的反应类型是 ;F→G的反应类型为 ;
(4)E与H反应的化学方程式为 :
(5)E有多种同分异构体,符合下列条件的同分异构体有 种,其中在核磁共振氢谱中出现四组峰的是 (写出结构简式)。
①芳香族化合物;②红外光谱显示含有羧基;③能发生银镜反应;④能发生水解反应
(6) A也能一步转化生成E:![]() .试剂a可以用 溶液。
.试剂a可以用 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯容易发生聚合生成二聚体,该反应为![]() 。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
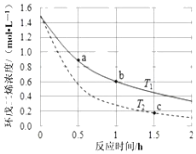
A.T1<T2
B.a点的正反应速率小于b点的逆反应速率
C.a点的反应速率小于c点的反应速率
D.反应开始至b点时,双环戊二烯平均速率约为:0.45molL-1h-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )
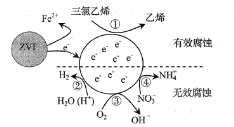
A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为: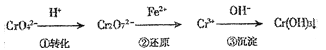
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl 3+6NH4HCO3=La2(CO3)3↓+6NH4C1+3CO2↑+3H2O,某化学兴趣小组利用下列实验装置模拟制备碳酸镧。下列说法不正确的是

A.制备碳酸镧实验流程中导管从左向右的连接顺序为:F→A→B→D→E→C
B.Y中发生反应的化学方程式为NH3·H2O+CaO=Ca(OH)2+NH 3↑
C.X中盛放的试剂是饱和NaHCO3溶液,其作用为吸收挥发的HCl,同时生成CO2
D.Z中应先通入CO2,后通入过量的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废水(镍主要以NiR2络合物形式存在)制取草酸镍(NiC2O4),再高温灼烧草酸镍制取三氧化二镍。工艺流程如图所示:
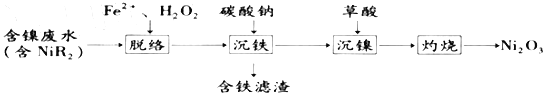
已知:①NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
②Ksp[Fe(OH)3] =2.16×10-39, Ksp[Ni(OH)2] =2×10-15
③Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH.
ii.R-+·OH=OH-+·R
iii.H2O2+2OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是_______。
(2)“沉铁”时,若溶液中c(Ni2+)=0.01 mol/L,加入碳酸钠调溶液的pH为______(假设溶液体积不变,1g6≈0.8)使Fe 3+恰好沉淀完全(离子的浓度≤1.0×10-5 mol/L),此时_____(填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时pH=3的草酸溶液中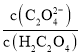 =____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
=____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
(4)加入Fe2+和H2O2能够实现“脱络”的原因是____________。
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为三氧化二镍。写出该反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的新型可充电 AGDIB电池(铝—石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1Al。放电过程如图,下列说法正确的是( )
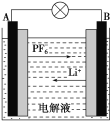
A.B为负极,放电时铝失电子
B.充电时,与外加电源负极相连一端电极反应为LiyAl-e-=Li++Liy-1Al
C.充电时A电极反应式为Cx+PF![]() -e-=CxPF6
-e-=CxPF6
D.废旧 AGDIB电池进行“放电处理”时,若转移1 mol电子,石墨电极上可回收7 g Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
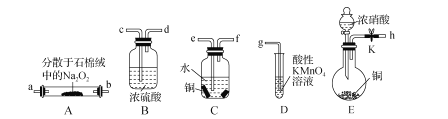
已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com