
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和NH3H2O反应的中和热△H=2×(﹣57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJmol﹣1
③ ![]() H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═ ![]() Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
⑤CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1
O2(g)═CO2(g)△H=﹣283kJmol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJmol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJmol﹣1
(1)上述热化学方程式中,不正确的有 , 不正确的理由分别是
(2)根据上述信息,写出C转化为CO的热化学方程式: .
(3)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)nB(g)+pC(s)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合图中的两个图象,以下叙述正确的是( ) 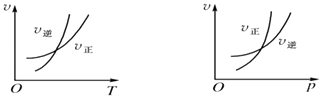
A.m>n,Q>0
B.m>n+p,Q>0
C.m>n,Q<0
D.m>n+p,Q>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类物质的叙述不正确的是
A.纤维素是高分子化合物
B.常温下淀粉溶液遇碘单质变蓝
C.糖类是由C、H、N三种元素组成的
D.淀粉除做食物外,主要用来生产葡萄糖和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中发生某化学反应2A(g)B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B,C的起始浓度都为0,反应物A的浓度(molL﹣1)随时间(min)的变化如图所示,请回答: 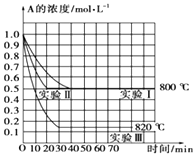
(1)在实验Ⅰ中,反应在0至40min内A的平均反应速率为molL﹣1min﹣1 .
(2)实验Ⅱ和实验Ⅰ的比较,可能隐含的反应条件是
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向(填“正”或“逆”)反应方向移动,该正反应是(填“放热”或“吸热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) 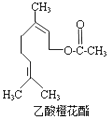
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
A.①②③
B.①②⑤
C.②④⑥
D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1mol SO2的质量是64g/mol
B. 2mol O2的摩尔质量是64g/mol
C. 当摩尔质量以g·mol-1为单位时,在数值上与阿伏加德罗常数个该物质的微粒的质量总和相等(质量以g为单位)
D. 1mol SO2中含有2mol氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
(1)氨是一种重要化工原料.合成氨原料气H2 , 可用天然气为原料制得,有关反应能量变化如图1所示.则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物.(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
时间/S | 0 | 20 | 40 | 60 | 80 |
N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在150℃达到平衡时,该反应平衡常数K= . (填数值)
②若最初通入N2O4 , 在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为 .
(ii)氨氧化制HNO3的尾气中含有NO和NO2 , 且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 6.02×1023个分子的体积约是22.4 L
B. 0.5 mol H2的体积为11.2 L
C. 1 mol气体的体积为22.4 L,则一定是在标准状况下
D. 标准状况下,体积相同的气体所含的分子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com