
| A. | b-m-n | B. | b+m-n | C. | b-m+n | D. | b+m+n |
科目:高中化学 来源: 题型:选择题
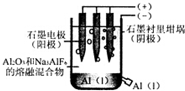
| A. | 电解过程中每转移12 mol电子,会产生2 molO2 | |
| B. | 加入助熔剂冰晶石(Na3AIF6)可降低电解的温度 | |
| C. | 电解过程中阳极反应式4A13++12e-→4Al | |
| D. | 若用该装置电解氯化铝溶液也能得到金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
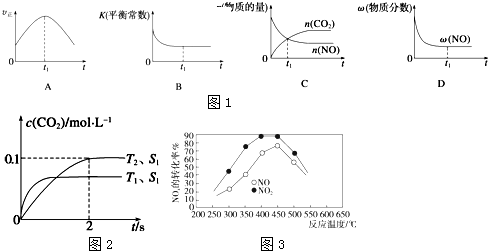
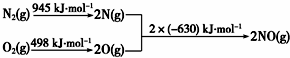
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.
在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
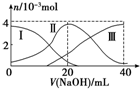 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )| A. | c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-) | B. | c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)>c(OH-) | ||
| C. | c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A) | D. | c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H+)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
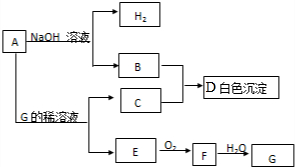
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
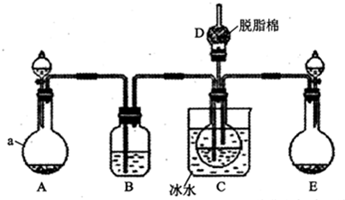

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com