
分析 (1)根据二氧化硫和三氧化硫的分子组成及N=nNA计算出原子个数之比;根据m=nM计算出二者质量之比;
(2)根据氯化氢的物质的量及反应关系式计算出需要氢氧化钠的质量;
(3 )同温同压下,气体摩尔体积相等,根据m=$\frac{V}{{V}_{m}}$计算其质量之比,根据V=$\frac{m}{M}$Vm计算其体积之比,根据N=$\frac{m}{M}$NA结合分子构成计算H原子个数之比,根据H原子个数及分子构成计算其物质的量之比;
(4)5mol/L的Mg(NO3)2溶液中硝酸根离子的物质的量浓度为10mol/L,然后根据溶液稀释过程中硝酸根离子的物质的量不变(c1v1=c2v2)计算出稀释后溶液中硝酸根离子的物质的量浓度.
解答 解:(1)当SO2和SO3中分子个数比为1:1 时,由N=nNA可知二者原子总数之比为:(1×3):(1×4)=3:4;质量之比为:(1×64):(1×80)=4:5,
故答案为:3:4;4:5;
(2)中和含0.2mol HCl的稀盐酸,根据反应的关系式:HCl~NaOH,需NaOH的质量为:40g/mol×0.2mol=8.0g,
故答案为:8.0;
(3)同温同压下,气体摩尔体积相等,根据m=$\frac{V}{{V}_{m}}$知,相同体积的NH3和H2S气体的质量比为其摩尔质量之比=17g/mol:34g/mol=1:2;
根据V=$\frac{m}{M}$Vm知,同质量的NH3和H2S气体的体积比为其摩尔质量之比的反比=34g/mol:17g/mol=2:1,
根据N=$\frac{m}{M}$NA知,其分子数之比等于其摩尔质量的反比=34g/mol:17g/mol=2:1,结合分子构成知,其H原子个数之比为3:1;
若两者所含氢原子个数相等,根据分子构成知,其分子个数之比为2:3,根据N=nNA知,其物质的量之比为2:3,
故答案为:1:2;2:1;3:1;2:3;
(5)原溶液中硝酸根离子的物质的量浓度为:c(NO3-)=5mol/L×2=10mol/L,硝酸根离子不发生水解,所以稀释过程中硝酸根离子的物质的量不变,设稀释后溶液中硝酸根离子浓度为c,则:10mol/L×a×10-3L=b×10-3L×c,解得:c=$\frac{10a}{b}$mol/L,
故答案为:$\frac{10a}{b}$.
点评 本题考查阿伏伽德罗定律内容及推理的应用,题目难度中等,明确物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数、气体摩尔体积等之间的关系为解答关键,试题有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 3.6mol/L | B. | 3.2mol/L | C. | 2.8mol/L | D. | 2.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中用饱和食盐水除去氯气中的氯化氢气体 | |
| B. | 实验室中久置的浓氨水碱性减弱 | |
| C. | 向硝酸亚铁溶液中滴加盐酸,溶液变为黄色 | |
| D. | 在较高温度下测定二氧化氮气体相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3溶液与氢氧化钠共热:H++OH-═H2O | |
| B. | NH3•H2O滴入AlCl3溶液产生沉淀:3OH-+Al3+═Al(OH)3↓ | |
| C. | NaOH溶液与NaHCO3溶液混合:OH-+H+═H2O | |
| D. | Al(OH)3固体溶于稀硫酸中:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO2)=0.25 mol•L-1 | B. | c(O2)=0.12 mol•L-1 | ||
| C. | c(SO2)+c(SO3)=0.15 mol•L-1 | D. | c(SO3)+c(O2)=0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
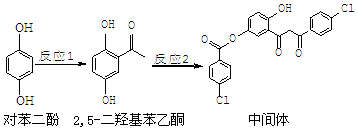
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有羰基和烃基两种含氧官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| B | 鉴别KBr溶液和KI溶液 | 分别加入新制氯水,再加入CCl4振荡、静置,观察 |
| C | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| D | 除去CuO中混有的Al2O3 | 加入过量盐酸溶液后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室效应的排放 | |
| B. | 胶体和溶液的本质区别是胶体具有丁达尔现象 | |
| C. | SiO2既能与氢氧化钠溶液反应又能与氢氟酸反应,SiO2是两性氧化物 | |
| D. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com