
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热NaCl使之融化 | D. | 氢气在氯气中燃烧 |
科目:高中化学 来源: 题型:解答题
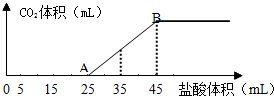
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
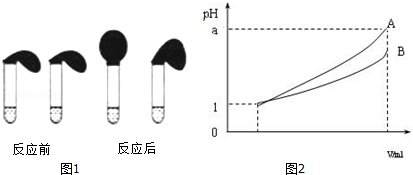
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1:C2=3:1 | |
| B. | C2的取值范围为0 mol•L-1<C2<0.15 mol•L-1 | |
| C. | X、Y的转化率不相等 | |
| D. | C1的取值范围为0 mol•L-1<C1<0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 | |
| B. | 用图2所示装置蒸发CuCl2溶液制得CuCl2晶体 | |
| C. | 用图3所示装置可由自来水制得蒸馏水 | |
| D. | 用图4所示装置从C2H5OH与C2H5COOCCH3的混合物中分离出乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117a3ρ | B. | $\frac{M}{{{N_A}{a^3}}}$ | C. | $\frac{234}{{{a^3}ρ}}$ | D. | $\frac{58.5}{{2{a^3}ρ}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(4b-2c)}{a}$ | B. | $\frac{(2b-c)}{a}$ | C. | $\frac{(4b-4c)}{a}$ | D. | $\frac{(2b-2c)}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清除可燃物 | B. | 使燃烧物与氧气隔绝 | ||
| C. | 降低燃烧物的着火点 | D. | 使燃烧物的温度降低到着火点以下 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com