

分析 (1)①根据盖斯定律计算2SO2(g)+4NH3•H2O(aq)+O2(g)═2(NH4)2SO4(aq)+2H2O(l)的△H;
②根据图1分析,60℃氧化速率最快;
③溶液吸收CO的能力以供循环使用即使反应平衡逆向移动,据此由平衡移动原理分析;
(2)温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动;α(NO)几乎为0的原因是无二氧化氮,温度高于800℃时,NO2几乎完全分解.
解答 解:(1)①SO2(g)+NH3•H2O(aq)═NH4HSO3(aq)△H1=a kJ•mol-1①
NH3•H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l)△H2=b kJ•mol-1②
2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq)△H3=c kJ•mol-1③
根据盖斯定律①×2+②×2+③可得2SO2(g)+4NH3•H2O(aq)+O2(g)═2(NH4)2SO4(aq)+2H2O(l)的△H=2a+2b+c kJ•mol-1,
故答案为:2a+2b+c;
②根据图1分析,60℃氧化速率最快,则在空气氧化(NH4)2SO3的适宜温度为60℃,
故答案为:60℃;
③溶液吸收CO的能力以供循环使用即使反应平衡逆向移动,该反应正向为放热、气体体积缩小的反应,根据平衡移动原理升温或减压平衡逆向移动,
故答案为:B;
(2)温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,温度高于800℃时,NO2几乎完全分解;
故答案为:>;温度高于800℃时,NO2几乎完全分解.
点评 本题考查盖斯定律的应用、依据图象分析化学反应平衡的影响因素,为高频考点,侧重分析与应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸、浓硝酸、硅酸钠溶液依次保存在棕色玻璃瓶、无色细口瓶、带胶塞细口瓶中 | |
| B. | 钠着火时不能用泡沫灭火器灭火 | |
| C. | 用饱和碳酸钠溶液除去CO2中混有的HCl | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3的溶解度高于NaCl | |
| B. | KNO3的溶解度低于NaCl | |
| C. | 含有多种杂质时,KNO3比NaCl更适合利用降温结晶(或重结晶)法进行提纯 | |
| D. | 含有多种杂质时,NaCl比KNO3更适合利用降温结晶(或重结晶)法进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 最高价氧化物对应水化物的酸性:M>Z | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
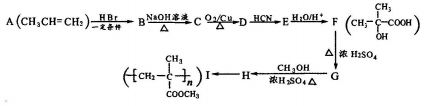
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
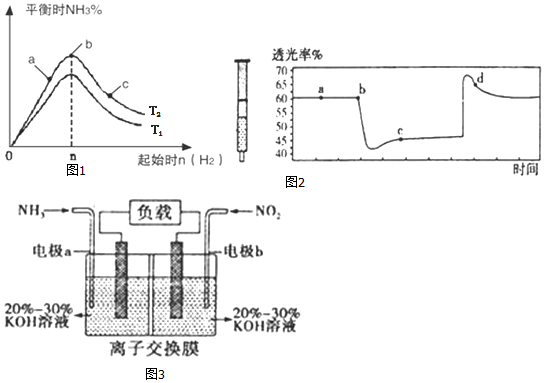
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,30g丙醇中存在的共价键总数为5NA | |
| C. | 2 mol Cu和足量热浓硫酸反应可生成2NA个SO3分子 | |
| D. | 电解法精炼铜时,若转移的电子数为NA个,则阳极质量减小32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑦⑩ | B. | ①③⑥⑧ | C. | ①④⑧⑨ | D. | ②⑤⑦⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com