
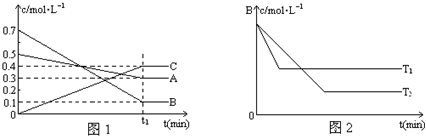


科目:高中化学 来源: 题型:
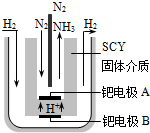 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 2 | 3 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
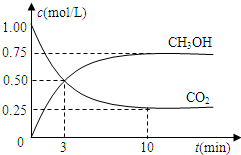
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
| a |
| b |

查看答案和解析>>
科目:高中化学 来源: 题型:
 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.查看答案和解析>>
科目:高中化学 来源: 题型:
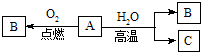 已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有下列转化关系:
已知A是应用最广泛、用量最大的一种金属单质,B是黑色固体,C是气体单质,在一定条件下有下列转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用无磷洗涤剂 |
| B、推广垃圾分类存放、回收和处理 |
| C、提倡使用手帕,减少餐巾纸的使用 |
| D、提倡使用一次性塑料餐具和塑料袋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com