
| A. | 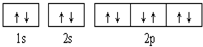 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 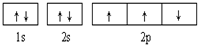 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 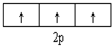 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
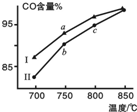 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )| A. | 相同条件下,催化剂Ⅱ催化效率更高 | |
| B. | b点表示上述反应在对应条件下的平衡状态 | |
| C. | 根据图象,无法判断该反应是否为吸热反应 | |
| D. | 该反应平衡常数表达式为K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
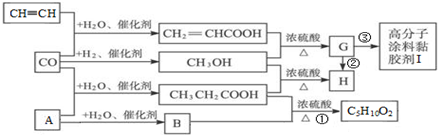
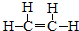 .
. CH3CH2COOC2H5+H2O,指出②的反应类型加成反应.
CH3CH2COOC2H5+H2O,指出②的反应类型加成反应.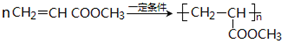 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.
(1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有5个σ键、1个π键 | |
| B. | C-H之间是碳的sp2杂化轨道与H的s轨道形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 | |
| C. | 只有sp2杂化轨道才形成π键 | |
| D. | C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形的σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
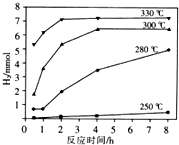 天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体.
天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
| A. | N | B. | Al | C. | Si | D. | Zn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com