
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为 .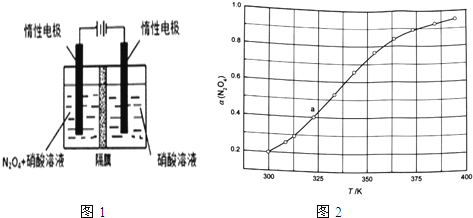
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H= .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为P0 , 第2.00min时体系压强为p,则p:p0= ;
1.00~3.00min内,O2的平均反应速率为 .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由 ,若要提高N2O4转化率,除改变反应温度外,其他措施有 (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由 .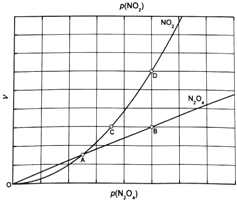
【答案】
(1)N2O4+2HNO3﹣2e﹣═2N2O5+2H+;△H=△H2﹣ ![]() △H1﹣△H3﹣
△H1﹣△H3﹣ ![]() △H4
△H4
(2)1.75;0.090mol?L﹣1?min﹣1
(3)115.2;吸热反应,温度升高,α(N2O4)增加,说明平衡右移;减小体系压强、移出NO2;![]() ;B点与D点,满足平衡条件υ(NO2)=2υ(N2O4)
;B点与D点,满足平衡条件υ(NO2)=2υ(N2O4)
【解析】(1)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3﹣2e﹣═2N2O5+2H+ ,
①2NO(g)+O2(g)═2NO2(g)△H1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2
③2NO2(g)N2O4(g)△H3
④2N2O5(g)═4NO2(g)+O2(g)△H4
将方程式②﹣ ![]() ①﹣③﹣
①﹣③﹣ ![]() ④得N2O4(g)+O3(g)═N2O5(g)+O2(g),得N2O4(g)+O3(g)═N2O5(g)+O2(g),则该反应△H=△H2﹣
④得N2O4(g)+O3(g)═N2O5(g)+O2(g),得N2O4(g)+O3(g)═N2O5(g)+O2(g),则该反应△H=△H2﹣ ![]() △H1﹣△H3﹣
△H1﹣△H3﹣ ![]() △H4 , 所以答案是:N2O4+2HNO3﹣2e﹣═2N2O5+2H+;△H=△H2﹣
△H4 , 所以答案是:N2O4+2HNO3﹣2e﹣═2N2O5+2H+;△H=△H2﹣ ![]() △H1﹣△H3﹣
△H1﹣△H3﹣ ![]() △H4;
△H4;
2)相同条件下,气体的物质的量之比等于其压强之比;
2N2O5(g)═4NO2(g)+O2(g)
开始(mol/L)1.00 0 0
反应(mol/L)0.50 1.00 0.25
2min(mol/L)0.50 1.00 0.25
反应前后气体的压强之比等于其物质的量之比,所以p:p0=(0.50+1.00+0.25)mol:1.00mol=1.75;
v(N2O5)= ![]() mol/(L.min)=0.18mol/(L.min),再根据同一时间段内各物质的反应速率之比等于其计量数之比得氧气反应速率为0.090 molL﹣1min﹣1 ,
mol/(L.min)=0.18mol/(L.min),再根据同一时间段内各物质的反应速率之比等于其计量数之比得氧气反应速率为0.090 molL﹣1min﹣1 ,
所以答案是:1.75;0.090 molL﹣1min﹣1;
3)①四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x﹣0.4x+0.8x)mol=1.4xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强= ![]() =151.2KPa,四氧化二氮的分压=151.2KPa×
=151.2KPa,四氧化二氮的分压=151.2KPa× ![]() =64.8KPa,二氧化氮的分压=151.2KPa×
=64.8KPa,二氧化氮的分压=151.2KPa× ![]() =86.4KPa,化学平衡常数K=
=86.4KPa,化学平衡常数K= ![]() =
= ![]() =115.2,
=115.2,
所以答案是:115.2;
②根据图知,升高温度转化率增大,升高温度平衡向吸热方向移动,则正反应是吸热反应,若要提高N2O4转化率,除改变反应温度外,其他措施有减小体系压强、移出NO2 ,
所以答案是:吸热反应;温度升高,α(N2O4)增加,说明平衡右移;减小体系压强、移出NO2;
③化学平衡常数Kp=[p(NO2)]2÷p(N2O4),二者的反应速率之比等于其计量数之比,
所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1p(N2O4)=2:1,
化学平衡常数Kp=[p(NO2)]2÷p(N2O4),
则K1= ![]() K2 . Kp ,
K2 . Kp ,
满足平衡条件υ(NO2)=2υ(N2O4)即为平衡点,BD点的压强之比等于其反应速率之比为1:2,所以BD为平衡点,
所以答案是: ![]() K2 . Kp;B点与D点,满足平衡条件υ(NO2)=2υ(N2O4).
K2 . Kp;B点与D点,满足平衡条件υ(NO2)=2υ(N2O4).
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池工作原理如图所示.则下列推断错误的是( )
A.放电时负极有CO2生成
B.正极反应为O2+2CO2+4e﹣═2CO32﹣
C.反应CH4+H2O ![]() 3H2+CO,每消耗1molCH4转移6mol 电子
3H2+CO,每消耗1molCH4转移6mol 电子
D.该电池可在常温或高温时进行工作,对环境具有较强的适应性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔奖.由青蒿素合成系列衍生物(它们的名称和代号如图所示)的路线如下: 
己知氢化青蒿素的分子式为C15H22O4 . 回答下列问题:
(1)青蒿素的分子式为 .
(2)反应①中,NaBH4的作用是 .
A.氧化剂
B.还原剂
C.催化剂
D.溶剂
(3)有机物D的结构简式为 .
(4)青蒿琥酯能够发生的反应类型有 .
A.酯化化反应
B.水解反应
C.还原反应
D.加聚反应
(5)参照H2Q的表示方式,写出反应②的化学方程式 .
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E.合成过程中,有机原料除H2Q、 ![]() 外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 原电池负极被氧化B. 任何化学反应都能设计成原电池
C. 在原电池内部阳离子向正极区域移动D. 原电池是把化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.
请回答下列问题:
(1)该“84消毒液”的物质的量浓度为molL﹣1 .
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(3)“84消毒液”可用氯气和氢氧化钠溶液反应制得,写出该反应的化学方程式: .
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液.
需要称量NaClO固体的质量为g.
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是(填选项字母).
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①1mol丙酮酸(  )在镍的催化下与1mol氢气发生加成反应转变成乳酸,则乳酸的结构简式为。
)在镍的催化下与1mol氢气发生加成反应转变成乳酸,则乳酸的结构简式为。
②在酸性条件下,与乳酸具有相同官能团的乳酸的同分异构体A发生消去反应生成B,则由A生成B的化学方程式为。
③B与甲醇生成的酯可以聚合,则该聚合物的结构简式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如图转化关系,其中A是单质. 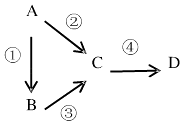
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,C是形成酸雨的主要物质.请写出C与B 反应的化学方程式: .
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因.请写出反应③的化学方程式: .
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少 量稀盐酸实现.请写出反应②的离子方程式: .
(4)若C是一种淡黄色固体,常用于呼吸面具中的供氧剂,D是一种强碱.则C作供氧剂时氧化产物和还原 产物的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是几种塑料的结构简式: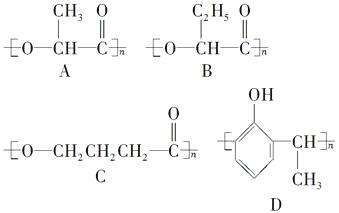
(1)A、B、C塑料有良好的生物适应性,能自然腐烂分解。它们在自然界可通过(填反应类型)反应进行降解。
(2)A的单体分子跟C的单体分子之间在一定条件下可生成环状酯,该环状酯可能是下列中的。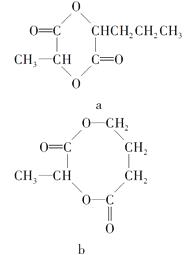
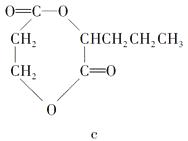
(3)B的单体在浓硫酸作用下,发生消去反应生成了不饱和酸,此不饱和酸属于链状酸的同分异构体还有种。
(4)写出制取D的化学方程式:。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com