
同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列说法中,正确的是( )
A. 原子半径:X>Y>Z B. 非金属性:X>Y>Z
C. 气态氢化物的稳定性:ZH3>H2Y>HX D. 原子序数:Z>Y>X
科目:高中化学 来源:2017届黑龙江省高三上学期第一次质检化学试卷(解析版) 题型:实验题

(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响? (填“偏大”“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面: 。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水: 。
(4)硅单质是一种重要的非金属单质,其用途是 (举一例)
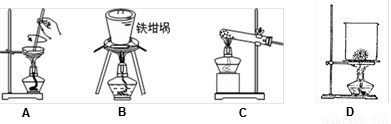
(5)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
(6)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:选择题
W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价之和等于0,其L层上电子数是M层上电子数的2倍;在常温常压下,W和R形成的两种物质可相互转化,但元素化合价没有变化;这4种元素的原子最外层电子数之和等于R原子的核电荷数的2倍。下列说法正确的是
A. 元素的非金属性强弱顺序为R>Y>W
B. R与其他三种元素均能形成共价化合物
C. 简单氢化物的热稳定性强弱顺序为R>W>Y
D. 原子半径大小顺序为r(W)>r(R)>r(X)>r(Y)
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第一次月考理综化学试卷(解析版) 题型:选择题
已知:NA表示阿伏加德罗常数,则下列说法不正确的是
A.31g白磷分子中所含p—p共价键数目为1.5NA
B.标准状况下,2.24LD2中所含中子的数目是0.2NA
C.常温常压下42g乙烯和丙烯的混合气体含氢原子数目为6 NA
D.常温下,向1L0.2mol/L的盐酸溶液通入氨气,当溶液PH=7时,溶液中NH4+的数目小于0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春第十一中高一下期末考化学(解析版) 题型:选择题
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃[ | 起始时物质的量/mol | 平衡时物质的量/mol[来] | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是( )
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=2.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡是,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春第十一中高一下期末考化学(解析版) 题型:选择题
将两个铂电极放置在稀H2SO4溶液中,然后分别向两极通入H2和O2,即可产生电流,称为燃料电池,下列叙述正确的是( )
①通入H2的电极为正极;②正极的电极反应是O2+2H2O+4e﹣═4OH﹣;
③正极的电极反应是O2+4e﹣+4H+═2H2O;④负极的电极反应式是H2﹣2e﹣+2OH﹣═2H2O;
⑤负极的电极反应式是H2﹣2e﹣═2H+;⑥放电时溶液中的阴离子向负极移动.
A.①③⑤ B.②④⑥ C.③⑤⑥ D.①③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春第十一中高一下期末考化学(解析版) 题型:选择题
反应4A(g)+5B(g)?4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol.下列叙述正确的是( )
A.A的平均反应速率是0.010 mol•L﹣1•s﹣1
B.容器中含D物质的量至少为0.45 mol
C.容器中A的物质的量一定增加了0.30 mol
D.容器中A、B、C、D的物质的量的比一定是4:5:4:6
查看答案和解析>>
科目:高中化学 来源:2017届河南信阳高考化学暑假自学自测专练:原子结构与性质(解析版) 题型:选择题
下列物质分子中既有σ键,又有π键的 ( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③B.④⑤⑥C.①③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省黔南州高一下学期期末化学试卷(解析版) 题型:填空题
(1)把0.2mol X气体和0.4mol Y气体混合于2L密闭容器中,使它们发生如下反应: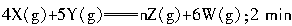 末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol
末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol 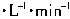 。计算:
。计算:
①前2min内用Y 的浓度变化表示的反应速率为 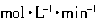
②化学方程式中n的值是 。
(2)在一定温度下,将4mol SO2与2mol O2放入4L的密闭容器中,在一定条件下反应,2SO2+O2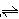 2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
2SO3。10min 时达到平衡状态。此时容器内压强比反应前减少20%,计算SO2的转化率为 。
(3)某温度时在2L容器中A、B、C 三种气态物质的物质的量(n)随时间(l)变化的曲线如图所示,由图中数据分析:
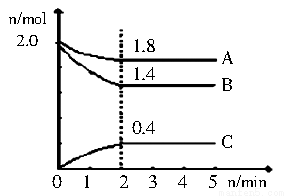
①该反应的化学方程式为
②下列叙述能说明上述反应达到平衡状态的是 。
A、混合气体的总物质的量不随时间的变化而变化
B、相同时间内消耗2n mol 的A的同时生成4nmol 的C
C、混合气体的总质量不随时间的变化而变化
D、容器内压强不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com