
| A. | 相对原子质量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 元素的化合价呈周期性变化 | D. | 核电荷数逐渐增大 |
分析 由原子的电子层排布可知,在周期表中的原子的电子层排布呈现周期性的变化,则元素的性质呈周期性的变化,以此来解答.
解答 解:A.元素的原子的相对原子质量增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故A错误;
B.由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故B正确;
C.元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,化合价属于元素的性质,故C错误;
D.核电荷数逐渐增大,不能解释元素性质周期性变化的原因,故D错误;
故选B.
点评 本题考查元素周期律的实质,为高频考点,把握元素性质周期性变化的原因为解答的关键,侧重分析与理解能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 (注明条件).
(注明条件). 、
、
 与1分子CH2=CHCOOCH2
与1分子CH2=CHCOOCH2 在一定条件下可发生类似反应①的反应,生成有机化合物W,W的结构简式为
在一定条件下可发生类似反应①的反应,生成有机化合物W,W的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的最高价氧化物对应的水化物中,Y(OH)m是一种两性氢氧化物,其碱性比X(OH)n弱,其酸性也比Z的最高价含氧酸弱 | |
| B. | 原子半径Z>X>Y | |
| C. | 单质的还原性Y>X | |
| D. | Xn+、Ym+、Zp-的半径:Xn+>Ym+>Zp- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气冷凝成水 | B. | 乙烯聚合成聚乙烯 | ||
| C. | 2NO2(g)?N2O4(g) | D. | CaCO3(s)?CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
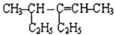 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯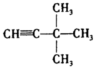 3,3-二甲基-1-丁炔.
3,3-二甲基-1-丁炔.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
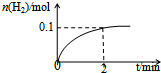 化学平衡:
化学平衡:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com