
 ��
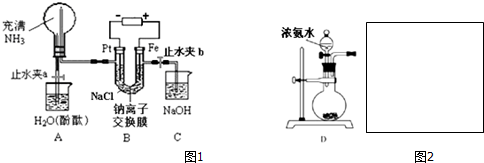
�� ���� ��1������Ȼ���ʱ���ڵ��ص������ǻ��õ缫������ʧȥ���ӷ���������Ӧ�����������ǵ�����е������ӷ����õ��ӵĻ�ԭ��Ӧ������������2H++2e-=H2����ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ�����n=$\frac{V}{{V}_{m}}$�������������ʵ��������ݵ���ת���غ���������ӵ����ʵ����������H+Ũ�ȼ�С��ʹ��H2O?OH-+H+��ƽ�������ƶ���
��2��ʵ�����Ʊ����������ù����Ȼ����������Ƽ��ȷ�Ӧ���ɰ�������ʯ����ˮ��Ӧ�����������ƣ��ų��������ȣ��ռ����ڰ�ˮ�е�ˮ�ų��������ȣ������ڰ������ݳ���
��3��װ��A��������Ȫʵ���װ�ã���ƿ�������ѹǿ��ʱ�ͻ������Ȫ�����ݴ���ѹǿԭ��ȷ����Ȫʵ�����ʱ��Һ��ߵͱ仯�����������Һ�������ȷ����Һ��ɫ�ı仯�����
��4���������ƿ��Ժͺ����������ӵ��η�����Ӧ���������������������������ױ�����Ϊ�����������ɫ������
��5���ڵ�ⱥ��ʳ��ˮʱ��Ҫʵ�ֵ���Ȼ�����Һ��Ŀ�ģ�Ӧ��ѡ����Ե缫���е�⣬��������Ϊ������ѡ����֤�������ڵ�װ�ã�
��� �⣺��1���ڵ��ص������ǻ��õ缫����ʧȥ���ӷ���������Ӧ��Fe-2e-�TFe2+���������ǵ�����е������������ӷ����õ��ӵĻ�ԭ��Ӧ����2H2O+2e-�TH2��+2OH-����2H++2e-�TH2�������������������������ʵ���Ϊ$\frac{11.2��1{0}^{-3}L}{22.4L/mol}$=0.0005mol��ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ��ʽ���Ĥ�������ӵ����ʵ���Ϊ0.0005mol��2=0.001mol�����������H+Ũ�ȼ�С��ʹ��H2O?OH-+H+��ƽ�������ƶ�����Һ��pH����
�ʴ�Ϊ��Fe-2e-�TFe2+��0.001������������2H++2e-=H2����H+Ũ�ȼ�С��ʹ��H2O?OH-+H+��ƽ�������ƶ���OH-Ũ������pH����
��2��ʵ�����Ʊ����������ù����Ȼ����������Ƽ��ȷ�Ӧ���ɰ�������Ӧ�Ļ�ѧ����ʽΪ��2NH4Cl+Ca��OH��2 $\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O����ʯ���백ˮ�е�ˮ��Ӧ�����������ƣ��ų��������ȣ������ڰ������ݳ�����ʯ��Ϊ���Ը���������������ﰱ�������������백ˮ����Ӧ�������������백ˮ��Ӧ���հ������ռ����ڰ�ˮ�е�ˮ�ų��������ȣ������ڰ������ݳ�������BE���ϣ�
�ʴ�Ϊ��2NH4Cl+Ca��OH��2 $\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
��3���ڵ����У���Ϊ���������缫�ϲ��������������Ե���A�ձ�����ѹ��������ˮ�Ӵ���������������ˮ����ˮ������������ɫ��Ȫ������ƿ��Һ��������������ർ��һ���̶Ⱥ������������뵼����ƽʱ����ƿ����ѹǿ��ȣ���Ȫ������������ڰ�ˮ�Լ��ԣ��������A�ձ���Һ�ʺ�ɫ�������ڵ������������������
�ʴ�Ϊ��A�ձ��е�ˮ������������ɫ��Ȫ��
��4����Aװ���е���Ȫʵ��ر�ֹˮ��a����ֹˮ��b��Cװ���У������������ӵ��κ����е��������Ʒ�����Ӧ���������������������������ױ�����Ϊ�����������ɫ��������Fe2++2OH-�TFe��OH��2����4Fe��OH��2+2H2O+O2�T4Fe��OH��3��д���ܷ�Ӧʽ��4Fe2++8OH-+2H2O+O2�T4Fe��OH��3����
�ʴ�Ϊ��Fe2++2OH-�TFe��OH��2����4Fe��OH��2+2H2O+O2�T4Fe��OH��3��д���ܷ�Ӧʽ��4Fe2++8OH-+2H2O+O2�T4Fe��OH��3����
��5���ڵ�ⱥ��ʳ��ˮʱ��Ҫʵ�ֵ���Ȼ�����Һ��Ŀ�ģ�Ӧ��ѡ����Ե缫���е�⣬����Fe�缫����Pt�ȶ��Ե缫��װ�������缫��λ�õȣ����Ե缫����Ȼ�����Һ�������缫��ӦʽΪ2Cl--2e-=Cl2������֤��������ѡ����۵⻯����Һ�������ɽ��⻯���������ɵ⣬��ʹ���۵⻯����Һ����ɫ��������B��Cװ��֮������һ��װ��Ϊ ��
��
�ʴ�Ϊ��Fe�� ��
��
���� ���⿼���Ϊ�ۺϣ������˵绯ѧ�еĵ��ԭ���ͻ�ѧ����ȵ����⣬������ѧ���ķ��������ͼ��������Ŀ��飬Ϊ�߿��������ͣ��Ѷ��еȣ�ע����NaCl��Һ֪ʶ�İ��գ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ��������ʵ�Ļ����������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1 | B�� | 2��1 | C�� | 2��3 | D�� | 1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
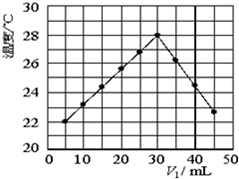 ��V1mL1.0mol•L-1 H2SO4��Һ��V2mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL����������������ȷ���ǣ�������
��V1mL1.0mol•L-1 H2SO4��Һ��V2mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL����������������ȷ���ǣ�������| A�� | ����ʵ��ʱ�����¶ȿ���Ϊ20�� | B�� | ��ʵ�������ѧ�ܿ���ת��Ϊ���� | ||
| C�� | NaOH��Һ��Ũ��Լ��1.5mol•L-1 | D�� | ��ʵ������кͷ�Ӧ�Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ�����CaCl2��CaO2���е������� | |
| B�� | ���µ�ѹ�£���������ȵ�CO��N2��C2H2�������庬�е�ԭ���� | |
| C�� | ͬ�¡�ͬѹ��ͬ�����CO��NO���е������� | |
| D�� | ���ʵ�����ͬ���������ֱ�������������ȫ��Ӧʱת�Ƶĵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2��ˮ��Ӧ��Na2O2+H2O=2Na++2OH-+O2�� | |
| B�� | �ö��Ե缫���MgCl2��Һ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+H2��+Cl2�� | |
| C�� | ����������Һ�м����ữ��˫��ˮ��2Fe2++2H++H2O2=2Fe3++2H2O | |
| D�� | Ba��OH��2��Һ�м��������NaHSO4��Һ��Ba2++SO42-+OH-+H+=BaSO4��+H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com