
| 配料 | 精盐、碘酸钾(KIO3)、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A. | 高温会导致碘的损失 | B. | 碘酸钾可氧化氯化钠 | ||
| C. | 可用淀粉检验碘盐中的碘酸钾 | D. | 该碘盐中碘含量是指碘酸钾的含量 |
分析 A.高温时碘酸钾易分解;
B.碘酸钾和氯化钠不反应;
C.淀粉试液能检验碘单质;
D.加碘食盐添加的是碘酸钾,碘的含量是指碘元素的含量.
解答 解:A.根据说明知,高温时碘酸钾易分解,否则会导致碘的损失,故A正确;
B.如果碘酸钾和氯化钠反应,则食盐中就不存在碘酸钾,实际上碘酸钾和氯化钠不反应,故B错误;
C.碘遇淀粉试液变蓝色,所以淀粉试液能检验碘单质,食盐中含有碘酸钾而不是碘单质,淀粉试液和碘不反应,所以不能用淀粉检验碘盐中的碘酸钾,故C错误;
D.加碘食盐添加的是碘酸钾,碘的含量是指碘元素的含量,不是碘酸钾的含量,故D错误;
故选A.
点评 本题考查了碘及其化合物的性质,加碘盐添加的是碘酸钾,注意碘遇淀粉试液变蓝色是碘的特性,可以据此现象确定碘的存在,难度不大.


科目:高中化学 来源: 题型:填空题
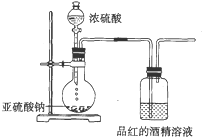 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑧ | B. | ②④⑥⑦⑨ | C. | ①③⑤⑥⑦ | D. | ①②④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁生锈,负极反应式为Fe-3e-═Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2O2↑ | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 小苏打与醋酸反应:HCO3-+H+═CO2↑+H2O | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用溴水鉴别植物油和己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com