

 ��GHOOC��CH2��4COOH��
��GHOOC��CH2��4COOH������ ����A�ķ���ʽ��֪��A��CH2=CH2��CH2=CH2��B��Ӧ����C��C������HOCH2CH2OH������B������������ϩ�����ӳɷ�Ӧ����CΪClCH2CH2Cl��ClCH2CH2Cl����ˮ�ⷴӦ����HOCH2CH2OH��������ȥ��Ӧ����D����D�Ľṹ��ʽ��CH2=CHCl��D�к���̼̼˫���������ܷ����Ӿ۷�Ӧ���ɸ߷��ӻ�����E��EΪ ������F��G���������֪���÷�ӦӦ�������۷�Ӧ������G��HOOC��CH2��4COOH����϶�Ӧ�л���Ľṹ�������Լ���ĿҪ��ɽ����⣮
������F��G���������֪���÷�ӦӦ�������۷�Ӧ������G��HOOC��CH2��4COOH����϶�Ӧ�л���Ľṹ�������Լ���ĿҪ��ɽ����⣮
��� �⣺����A�ķ���ʽ��֪��A��CH2=CH2��CH2=CH2��B��Ӧ����C��C������HOCH2CH2OH������B������������ϩ�����ӳɷ�Ӧ����CΪClCH2CH2Cl��ClCH2CH2Cl����ˮ�ⷴӦ����HOCH2CH2OH��������ȥ��Ӧ����D����D�Ľṹ��ʽ��CH2=CHCl��D�к���̼̼˫���������ܷ����Ӿ۷�Ӧ���ɸ߷��ӻ�����E��EΪ ������F��G���������֪���÷�ӦӦ�������۷�Ӧ������G��HOOC��CH2��4COOH��
������F��G���������֪���÷�ӦӦ�������۷�Ӧ������G��HOOC��CH2��4COOH��
��1�������Ϸ�����֪��EΪ ��GΪHOOC��CH2��4COOH��
��GΪHOOC��CH2��4COOH��
�ʴ�Ϊ�� ��HOOC��CH2��4COOH��
��HOOC��CH2��4COOH��
��2����Ӧ�ڵĻ�ѧ����ʽΪClCH2CH2Cl+NaOH$��_{��}^{CH_{3}CH_{2}OH}$CH2=CHCl+NaCl+H2O��
��Ӧ�ܻ�ѧ����ʽΪCH2ClCH2Cl+2NaOH$��_{��}^{ˮ}$HOCH2CH2OH+2NaCl��
�ʴ�Ϊ��ClCH2CH2Cl+NaOH$��_{��}^{CH_{3}CH_{2}OH}$CH2=CHCl+NaCl+H2O��CH2ClCH2Cl+2NaOH$��_{��}^{ˮ}$HOCH2CH2OH+2NaCl��
��3����������ķ�����֪����Ӧ��Ϊ��ϩ�������ļӳɷ�Ӧ����Ӧ���Ҷ������Ѷ�������۷�Ӧ��
�ʴ�Ϊ���ӳɷ�Ӧ�����۷�Ӧ��
���� ��������ϩ�ļӳɷ�ӦΪ���У��������ȴ�������ȥ��ˮ�⣬�������˼Ӿۺ����۷�Ӧ�����ݹ������������ʵ���Ҫ�����ǽ���ؼ����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
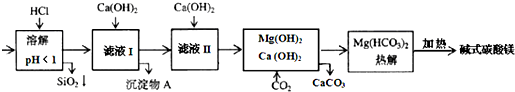
| �������� | Fe��OH��3 | Al��OH��3 | Mg��OH��2 |
| ���ܶȻ���KSP | 4.0��10-38 | 1.25��10-33 | 1.8��10-11 |
| A�� | ����ҺI�У��ӹ�����Ca��OH��2ʹFe3+��Al3+������ȫ | |
| B�� | ��ҺI�У���Ca��OH��2��Al3+��Fe3+�ȳ�����ȫ | |
| C�� | �����£���Ca��OH��2����ҺI��pH���ڵ�4.7ʱ��Al3+�պó�����ȫ | |
| D�� | ����ʽ̼��þ��aMgCO3•b Mg��OH��2�����¼��ȷֽ�õ�6.6g CO2��8.0g MgO���ɴ˿�֪�仯ѧʽΪMgCO3•3Mg��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢� | C�� | �ۢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH�TCH2�� | B�� | ��Ȳ�ͱ� | C�� |  �� �� | D�� | ����ͼ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | NaOH����NaCl����KNO3����MgCl2 | B�� | NaOH����NaCl����HCl����FeCl3 | ||
| C�� | Na2SO4����BaCl2����HCl����K2CO3 | D�� | Na2CO3����HNO3��HCl����Ba��NO3��2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com