
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
分析 A.乙醇与水互溶,溴苯与水分层;
B.丙醛和1-丙醇中化学键不同、官能团不同;
C.苯和正庚烷与溴水的萃取现象相同;
D.1-溴丙烷和2-溴丙烷中H的种类分别为3、2.
解答 解:A.乙醇与水互溶,溴苯与水分层,现象不同,可利用水鉴别,故A正确;
B.丙醛和1-丙醇中化学键不同、官能团不同,则红外光谱可鉴别丙醛和1-丙醇,故B正确;
C.苯和正庚烷与溴水的萃取现象相同,不能鉴别,故C错误;
D.1-溴丙烷和2-溴丙烷中H的种类分别为3、2,则用核磁共振氢谱可鉴别1-溴丙烷和2-溴丙烷,故D正确;
故选C.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的结构、性质为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
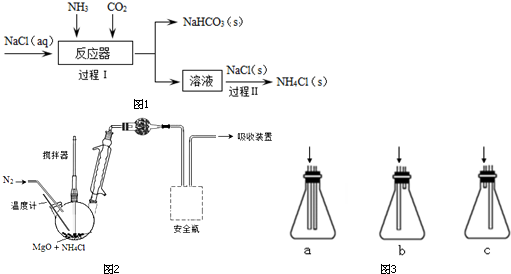
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
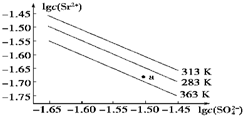
| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol
某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
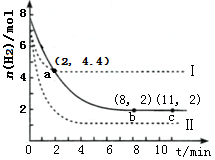 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 从反应开始至a 点,ν(CO2)=0.9 mol•L-1•min-1 | |
| B. | 曲线Ⅰ对应的条件改变可能是减小压强 | |
| C. | 曲线Ⅱ对应的条件改变可能是充入氢气 | |
| D. | 该温度下,此反应的化学平衡常数的数值为0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

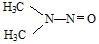 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com