
| A. | SiO32- | B. | Si2O52- | C. | SiO44- | D. | Si4O104- |
科目:高中化学 来源: 题型:选择题
| A. | 使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- | |
| B. | 含有较多CO32-的溶液中:K+、Fe3+、SO42-、NO3- | |
| C. | 水电离产生的氢离子浓度为10-11mol/L:K+、Ca2+、HCO3-、NO3- | |
| D. | 存在较多的AlO2-的溶液中:Mg2+、Ba2+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Cu、稀硫酸组成原电池,负极反应式为:Al-3e-═Al3+ | |
| C. | 由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| D. | 由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
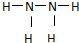 ,过氧化氢的电子式
,过氧化氢的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、Cl2均能使品红溶液褪色 | |
| B. | NH4Cl晶体、固态碘受热时均能变成气体 | |
| C. | 苯酚,乙烯均能使溴水褪色 | |
| D. | 福尔马林,葡萄糖与新制的Cu(OH)2共热均有红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,C的化学式Cl2.
,C的化学式Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )| A. | 容器甲乙中反应的平衡常数相等 | |
| B. | 容器甲乙中反应的起始速率不等 | |
| C. | 达平衡时,容器甲、乙中各组分的体积分数不等 | |
| D. | 达平衡时,容器甲、乙中放出的热量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s 浓度(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.10 | c1 | 0.05 | c3 | a | b |
| c(NO2) | 0.00 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com