
| A. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1的溶液中:Na+、K+、SiO32-、SO32- | |
| B. | pH=1的溶液中:K+、Al3+、SO42-、F- | |
| C. | 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2- |
分析 A.$\frac{{K}_{w}}{c({H}^{+})}$=0.1的溶液,显碱性;
B.pH=1的溶液,显酸性;
C.与镁反应生成氢气的溶液,显酸性;
D.AlO2-促进HCO3-的电离.
解答 解:A.$\frac{{K}_{w}}{c({H}^{+})}$=0.1的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.pH=1的溶液,显酸性,不能大量存在F-,故B错误;
C.与镁反应生成氢气的溶液,显酸性,若存在NO3-与Mg发生氧化还原反应不生成氢气,故C错误;
D.AlO2-促进HCO3-的电离生成氢氧化铝沉淀,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的离子共存,选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴苯(溴) | 水 | 分液 |
| B | 乙醇(乙酸) | NaOH溶液 | 分液 |
| C | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子与氯离子F之间存在互相吸引又互相排斥的相互作用 | |
| B. | 不存在氯化钠的分子 | |
| C. | 每个钠离子同时吸引6个氯离子,每个氯离子同时吸引6个钠离子 | |
| D. | 在一个钠离子周围距离相等,并且最接近的钠离子共有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精消毒的原理是将病毒氧化达到消毒目的 | |
| B. | 加热消毒是因为高温下蛋白质发生了变性 | |
| C. | 自来水净化过程中加入明矾的作用是消毒杀菌 | |
| D. | 使用84消毒液(有效成分次氯酸钠)时通入CO2或SO2均可增强消毒效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
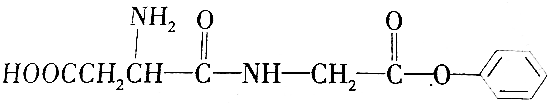
| A. | A的分子式为C12H15O5N2 | |
| B. | 通常用酒精梢灭该细菌,其原理是酒精使细菌中的蛋白质水解而失去生理活性 | |
| C. | A的水解产物中一定含有醇类 | |
| D. | 1 mol A最多可以与1 L 4mol•L-1的Na0H溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
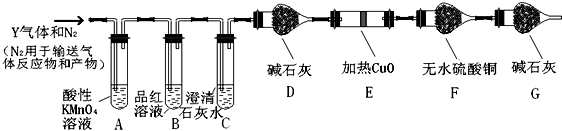 (2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.
(2)写出产生CO2的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O.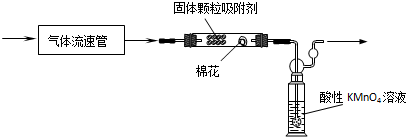
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com