
【题目】下列各项反应对应的图像正确的是( )
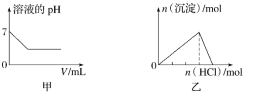
A.图甲为25℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
【答案】C
【解析】
A.亚硫酸为酸性,其pH小于7,与图象不符,发生Cl2+H2SO3+H2O=2Cl-+4H++SO42-后,随着氯气的通入,pH会降低,直到亚硫酸反应完全,pH不变,故A错误;
B.NaAlO2溶液中通入HCl气体,发生H++AlO2-+H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,图中上升与下降段对应的横坐标长度之比应为1:3,故B错误;
C.向少量氯化铁溶液中加入铁粉,发生Fe+2FeCl3=3FeCl2,则Fe元素的质量增加,Cl元素的质量不变,所以Cl的质量分数减小,至反应结束不再变化,故C正确;
D.BaSO4饱和溶液中,存在溶解平衡,加硫酸钠,硫酸根离子浓度增大,溶解平衡逆向移动,溶解度减小,故D错误;
故答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,FeS、CuS的溶度积常数分别为6.3×10-18 mol2·L-2、1.3×10-36 mol2·L-2。下列说法中,错误的是( )
A.25℃时,FeS的溶解度大于CuS的溶解度
B.反应CuSO4+H2S=CuS↓+H2SO4不能发生
C.可用FeS作沉淀剂除去废水中的Cu2+
D.25℃时,饱和CuS溶液中,Cu2+的浓度为![]() ×10-18 mol·L-1
×10-18 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)与时间(t)关系如右图。反应中镁和铝的
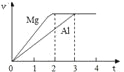
A. 物质的量之比为3:2 B. 质量之比为3:2
C. 摩尔质量之比为2:3 D. 反应速率之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A.一定条件下,1molFe与1molCl2充分反应,Fe失去的电子数目为3NA
B.在常温常压下,11.2L氯气含有分子数为0.5NA
C.7.8gNa2O2与水完全反应时,转移的电子数为0.1NA
D.1.2gNaHSO4晶体中所含离子数为0.03NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是
编号 | 实验目的 | 实验方案 |
A | 探究催化剂对 | 两支试管中均盛有 |
B | 探究 | 向盛有 |
C | 比较 | 两支试管中分别放入已除去氧化膜、大小相同的镁条和铝条,再各加入 |
D | 制取并纯化氢气 | 向稀盐酸中加入纯锌粒,将生成的气体依次通过浓硫酸、 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①BaCl2固体 ②金刚石 ③NaOH固体 ④固体甲烷四种物质,按下列要求填空:
(1)熔化时不需要破坏化学键的是____(用序号填空,下同),只含离子键的是____,属于共价化合物的是____,熔点最高的是____。
(2)写出NaOH的电子式____,甲烷的空间构型____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。

①已知100 ℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____。
②图中的P1___P2(填“<”、“>”或“=”),100 ℃时平衡常数为____。
③在其他条件不变的情况下降低温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
(2)在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) Ⅱ
CH3OH(g) Ⅱ
①该反应的ΔH______0,ΔS_____0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是(____)
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:

已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com