
【题目】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是________________。
(2)吸收塔中反应的离子方程式是___________。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用______(写化学式)。
(2)加入试剂②后反应的离子方程式是_______________。
(3)步骤①包括加热、蒸发、冷却、结晶、____________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________。
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl26H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl26H2O在523℃以上分解的化学方程式是___________。
(2)现用1molMgCl26H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水_______g(精确到0.1),该盐酸中溶质的物质的量浓度是_________mol/L(精确到0.1)。
【答案】 2Br-+Cl2=2Cl-+Br2 SO2+2H2O+Cl2=4H++2Cl-+SO42- Ca(OH)2(答NaOH也得分) Mg(OH)2+2H+=Mg2++2H2O 过滤 MgCl2(熔融) ![]() Mg+Cl2↑ MgCl2·6H2O=MgO+2HCl↑+5H2O↑(气体箭头不打或不全扣1分) 36.9 11.9
Mg+Cl2↑ MgCl2·6H2O=MgO+2HCl↑+5H2O↑(气体箭头不打或不全扣1分) 36.9 11.9
【解析】浓缩海水中主要含MgSO4、NaCl、NaBr,加入试剂氢氧化钙或氢氧化钠沉淀镁离子,过滤得到混合溶液中通入氯气,得到低浓度的溴单质,进入吸收塔用二氧化吸收得到溴化氢,再通入氯气得到高浓度的溴单质,氢氧化镁沉淀中加入氢氧化钠溶液溶解得到氯化镁溶液,加热、蒸发、冷却、结晶、过滤得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到氯化镁固体,电解熔融氯化镁得到镁和氯气。
I.(1)浓缩溴水与试剂①反应得到氢氧化镁,剩余混合液中含有的是溴离子,通入氯气后,氯气与溴离子反应生成单质溴和溴离子,其离子方程式是Cl2+2Br-═2 Cl-+Br2,故答案为:Cl2+2Br-═2 Cl-+Br2;
(2)单质溴经过空气吹出法后被富集在吸收塔,通入的二氧化硫与单质溴反应生成硫酸和氢溴酸,其化学方程式是:Br2+SO2+2H2O═2H2SO4+2HBr,即其离子方程式为Br2+SO2+2H2O═4H++SO42-+2 Br-.在氧化还原反应中氧化剂的氧化性比氧化产物的氧化性强,根据Cl2+2Br-═2 Cl-+Br2得,氧化性Cl2>Br2.根据得Br2+SO2+2H2O═4H++SO42-+2 Br-,氧化性Br2>S O2.即氧化性为Cl2>Br2>SO2,故答案为:Br2+SO2+2H2O═4H++SO42-+2 Br-;
II.(1)浓缩溴水与试剂①反应得到氢氧化镁,则试剂①可以是氢氧化钠或氢氧化钙,故答案为:NaOH或Ca(OH)2;
(2)氢氧化镁与试剂②反应得到氯化镁,则试剂②必是盐酸,反应的化学方程式是Mg(OH)2+2 HCl═MgCl2+2 H2O,其离子方程式是Mg(OH)2+2 H+═Mg2++2H2O,故答案为:Mg(OH)2+2 H+═Mg2++2H2O;
(3)要从氯化镁溶液得到含结晶水的氯化镁,就需要蒸发、冷却、结晶,并通过过滤把固体从溶液中分离出来,故答案为:过滤;
(4)电解熔融状态的无水氯化镁可以得到氯气和镁单质,即MgCl2(熔融)![]() Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
III.(1)根据题意MgCl26H2O在523℃以上分解,实际上是MgCl26H2O高温失水形成氯化镁溶液,氯化镁水解生成氢氧化镁和氯化氢,然后氢氧化镁高温下分解得到氧化镁,即MgCl26H2O在523℃以上分解得到的应该是氧化镁、氯化氢和水,其化学方程式是MgCl26H2O![]() MgO+2 HCl↑+5H2O↑,故答案为:MgCl26H2O
MgO+2 HCl↑+5H2O↑,故答案为:MgCl26H2O![]() MgO+2 HCl↑+5H2O↑;
MgO+2 HCl↑+5H2O↑;
(2)得到的盐酸的质量是1.19g/cm3×168mL═199.92g.根据MgCl26H2O![]() MgO+2 HCl↑+5H2O↑可知,1molMgCl26H2O分解可得2mol氯化氢、5mol水,二者的质量共73g+90g=163g,则需要加水:199.92g-163g=36.92g,即需要加水36.9g;因为该盐酸中含有2molHCl,体积为0.168L,则c(HCl)═
MgO+2 HCl↑+5H2O↑可知,1molMgCl26H2O分解可得2mol氯化氢、5mol水,二者的质量共73g+90g=163g,则需要加水:199.92g-163g=36.92g,即需要加水36.9g;因为该盐酸中含有2molHCl,体积为0.168L,则c(HCl)═![]() =11.9mol/L,即该盐酸中溶质的物质的量浓度是11.9mol/L,故答案为:36.9 g;11.9。
=11.9mol/L,即该盐酸中溶质的物质的量浓度是11.9mol/L,故答案为:36.9 g;11.9。


科目:高中化学 来源: 题型:
【题目】(1)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:

①该反应在_________min时达到化学平衡状态。
②该反应的化学方程式是______________________。
③从开始到2min,Z的平均反应速率是________________________。
(2)某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:

①若a、b是两种活动性不同的金属,则活动性a____b(填>、<或=);
②电路中的电子从____经导线流向_____(填a或b);
③溶液中的SO42-向________极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为_________________。
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:

通入甲醇的电极是_____(填“正”或“负”)极,反应时该电极附近的现象是_____________________________,溶液中K+向____(填“正”或“负”)极移动:写出正极反应式:_______________;若电池工作过程中通过2mol电子,则理论上消耗O2__L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体氯化钠配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的( )
A. 500 mL容量瓶 B. 胶头滴管 C. 试管 D. 托盘天平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金与铁的物理性质的比较如表所示( )
项目 | 熔点/°C | 密度/ | 硬度(金刚 | 导电性 |
某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
铁 | 1 535 | 7.86 | 4.5 | 17 |
从性能看,该合金不适合制( )
A.导线
B.门窗框
C.炉具
D.飞机外壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物结构和性质的说法正确的是
A. 乙烯、苯和乙酸均能与氢气发生加成反应
B. 某芳香烃的分子式为C10H14,常温下它可使酸性KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种
C. 1 mol的有机物(结构如右图)最多能与含5mol NaOH的水溶液完全反应

D. 蛋白质盐析会使蛋白质失去生理活性,加热、紫外线照射等措施可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用氯酸钾与密度为1.19gcm﹣3,溶质质量分数为36.5%的浓盐酸反应制取氯气。
I.反应方程式如下:___KClO3+ HCl= KCl+ Cl2↑+ H2O
(1)配平方程式,并用双线桥法表示上述反应中电子转移的方向和数目。
(2)若反应中被氧化的盐酸为5mol,则生成的氯气体积为__________(标准状况下)。
II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:

(1)证明氯气和水反应的实验现象为__________,反应的化学方程式是__________。
(2)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是__________,漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是__________。
III.乙同学用上述浓盐酸配置0.100 mol·L-1的稀盐酸480 mL,下列说法正确的是__________。
A.取用240 mL的容量瓶
B.应量取上述浓盐酸的体积为4.2mL
C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,所配溶液浓度偏小
D.定容时,仰视刻度线所配溶液浓度偏大
E.量取上述浓盐酸的体积时俯视刻度线所配溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.砷(As)是第四周期VA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应:![]() 。溶液中
。溶液中![]() 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
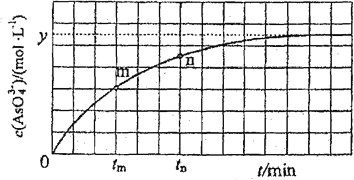
①下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(![]() )
)
C.![]() /
/![]() 不再变化
不再变化
d.c(I-)=2ymol·L-1
②tm时,V正________V逆(填“大于”“小于”或“等于”)。
③tm时V逆________tm时V逆(填“大于”“小于”或“等于”),理由是____________________________。
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)________。
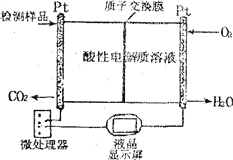
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式__________________________
正极反应式__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com