
分析 通入氯气发生反应:Cl2+2KBr=2KCl+Br2,蒸发灼烧溴挥发,最终得到固体为KCl,根据固体质量差,利用差量法计算KBr的质量,再根据总质量计算原混合物中KCl质量,进而计算KCl、KBr的物质的量,可得所配溶液中K+、Cl-、Br-的物质的量之比.
解答 解:最后蒸干得到的固体为氯化钠,质量减少了(13.4g-11.175)g=2.225g,
Cl2+2KBr=2KCl+Br2 固体质量减少△m
2×119 (160-71)g=89g
m 2.225g
所以m=$\frac{2.225g×2×119}{89}$=5.95g
则化合物中KCl为13.4g-5.95g=7.45g
所以n(KBr)=$\frac{5.95g}{119g/mol}$=0.05mol,
n(KCl)=$\frac{7.45g}{74.5g/mol}$=0.1mol
所配溶液中K+、Cl-、Br-的物质的量之比:(0.1+0.05)mol:0.1mol:0.05mol=3:2:1,
答:所配溶液中K+、Cl-、Br-的物质的量之比为3:2:1.
点评 本题考查有关混合物反应的计算,掌握差量法在计算出的应用,根据质量守恒定律理解差量法,试题培养了学生的分析、理解能力及化学计算能力.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO3中:c(Na+)>c(HSO3-)>c(OH-)>c(H+) | |
| B. | Na2CO3溶液:c(OH-)═c(HCO3-)+c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中:c(H+)+c(M+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
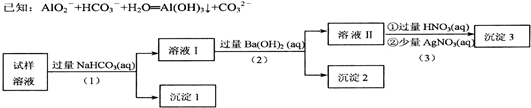
| A. | 试样溶液中若(1)加入的是稍过量的FeCl3溶液,则沉淀1物质的成分不变 | |
| B. | 试样溶液中肯定存在阴离子A1O2-、C1-,阳离子NH4+、K+至少存在1种 | |
| C. | 上述沉淀2放置在干燥空气中一段时间后,称量质量没有变化,可判断试样中无SO32- | |
| D. | 实验中,如果将操作(1)与(3)所加的试剂互换,过程中的实验现象仍会完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H20(l)△H=-571.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
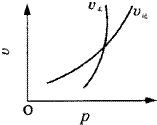 符合图象的反应为( )
符合图象的反应为( )| A. | N2O3(g)?NO2(g)+NO(g) | B. | 3NO2(g)+H2O (l)?2HNO3(l)+NO(g) | ||
| C. | 4NO2(g)+5O2 (g)?4NO(g)+6H2O(g) | D. | CO2(g)+C(s)?2CO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有CO32- | |
| B. | 原溶液中一定含有K+ | |
| C. | 原溶液中一定含有Al3+ | |
| D. | 不能确定SO42-是否存在于原溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
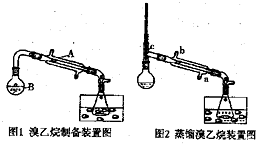 已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:| 溶解性(本身均做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 水混溶,易溶于有机溶剂 | 78.5 | 0.8 | |
| 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com