
【题目】化学科学需要借助化学专用语言来描述,现有下列化学用语:
①Cl-的结构示意图:![]() ;
;
②羟基的电子式:![]() ;
;
③HClO的结构式:H—Cl—O;
④NaHCO3在水中的电离方程式:NaHCO3===Na++H++CO32-;
⑤碳酸氢铵与足量的氢氧化钠溶液混合:HCO![]() +OH-===CO32-+H2O;
+OH-===CO32-+H2O;
⑥CO2的比例模型:![]() ;
;
⑦原子核内有10个中子的氧原子:![]() O。其中说法正确的是( )
O。其中说法正确的是( )
A.④⑤⑥B.①②⑦C.②③④⑥D.②③⑤⑥⑦
【答案】B
【解析】
①Cl-的质子数为17,核外电子为18,则Cl-的结构示意图为![]() ,故①正确;
,故①正确;
②羟基为-OH,O原子的周围有7个电子,则羟基的电子式为![]() ,故②正确;
,故②正确;
③HClO中O可形成2个共价键,Cl只能形成1个共价键,结构式为H-O-Cl,故③错误;
④NaHCO3为弱酸的酸式盐,在水中的电离出Na+、HCO3-,电离方程式为NaHCO3=Na++HCO3-,故④错误;
⑤碳酸氢铵与足量的氢氧化钠溶液混合,反应的离子方程式应为:NH4++HCO3-+2OH-=CO32-+2H2O+NH3↑,故⑤错误;
⑥同一周期中,原子序数越大,半径越小,即O原子半径小于C原子,此比例模型不正确,故⑥错误;
⑦氧原子质子数为8,原子核内有10个中子的氧原子的质量数为18,原子符号为![]() O,故⑦正确;
O,故⑦正确;
正确的有①②⑦,故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池工作原理示意图,电池工作过程中左右两烧杯所盛放的溶液中不允许引入杂质。下列有关说法中正确的是( )

A.所用离子交换膜为阳离子交换膜
B.Cu电极的电极反应为Cu-2e-=Cu2+
C.电池工作过程中,CuCl2溶液浓度降低
D.Fe为负极,电极反应为Fe2++2e-=Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。

已知:氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
(1)B中加入的干燥剂是____(填序号)。
①浓硫酸 ②无水氯化钙 ③碱石灰
(2)能证明氨与氧化铜反应的现象是C中________。
(3)D中有无色液体生成。设计实验检验D中无色液体的成分:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6﹣n]m,该物质广泛应用于日常生活用水和工业废水的处理。该物质可溶于盐酸产生相应的金属阳离子。为检测PAFC中铝和铁元素的含量,采用如图所示流程进行:
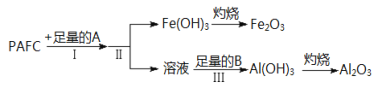
回答下列问题:
⑴PAFC中铁元素的化合价为_____,如何检验该元素的存在___________________
⑵步骤I中的试剂A是_______________(从“氢氧化钠溶液”、“氨水”中选择)步骤Ⅲ中的试剂B是_____________,离子方程式是__________
⑶步骤Ⅱ的操作是______________________
Ⅱ. ⑴甲同学用氢氧化钠溶液和氯化亚铁溶液制备氢氧化亚铁沉淀,该同学将氢氧化钠溶液加入氯化亚铁溶液中,观察到的现象是____________,反应过程中发生反应的化学方程式是_________。乙同学通过如下改进制备氢氧化亚铁:
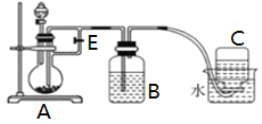
实验提供的试剂:铁屑、3mol/L硫酸溶液、NaOH溶液。请回答下列问题:
⑵①分液漏斗中盛装的试剂是______________溶液 (从“H2SO4”和“NaOH”中选择)。
②实验开始时应将止水夹E___________ (从“打开”和“关闭”中选择)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2 +O2![]() 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
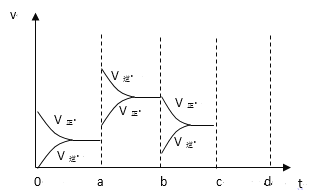
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。解释曲线变化原因 __________________。
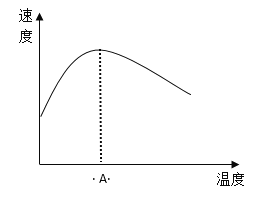
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(两侧温度相同)。则混合气体中CO和CO2的分子个数比为 ( )

A.1:1 B.1:3 C.2:1 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的H原子数成正比。例如,乙醛的结构式为CH3CHO,其PMR谱中有两个信号,其强度之比为3:1.分子式为C3H6O2的有机物,如果在PMR谱上观察到的氢原子给出的峰有两种情况。第一种情况峰给出的强度比为3:3,请写出其对应化合物的结构简式 ________;第二种情况峰的强度比为3:2:1,请写出该化合物的可能的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是
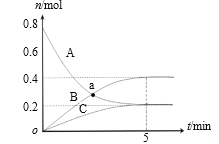
A.a点时,υ(A) =υ(B)
B.反应开始到5min,B的物质的量增加了0.2 mol
C.反应的化学方程式为:3A![]() 2B+C
2B+C
D.反应开始到5min,υ(C) =0.04 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com