
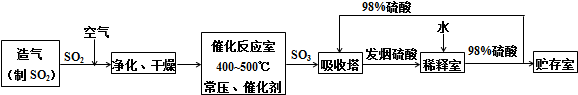
| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| 高温高压 |
| 50 |
| 3 |
| 100 |
| 3 |
| 100/3×22.4L |
| 20.0×103L |
| 2×98 |
| 10.0t×98% |
| 2×136+234 |
| x |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
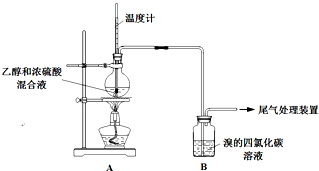 实验室制乙烯时,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用如图实验验证.(气密性已检验,部分夹持装置略).
实验室制乙烯时,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用如图实验验证.(气密性已检验,部分夹持装置略).| 操 作 | 现 象 |
| 点燃酒精灯, 加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕, 清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
| 设 计 | 现 象 | |
| 甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | Br2的CCl4溶液褪色 |
乙 | 与A连接的装置如下: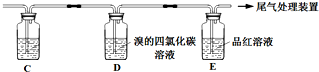 | D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
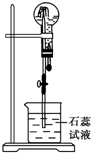 物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B.按如图所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B.按如图所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉.查看答案和解析>>
科目:高中化学 来源: 题型:

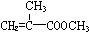 ) 合成路线的一部分.现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6MPa条件下羰基化,一步制得
) 合成路线的一部分.现在人们利用最新开发的+2价钯的均相钯催化剂体系,将丙炔在甲醇和一氧化碳存在下,于60℃、6MPa条件下羰基化,一步制得 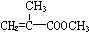 ,其化学方程式为:
,其化学方程式为: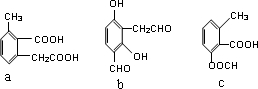 .
.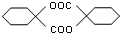 ,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)
,模仿以上流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)| 浓硫酸 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
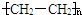 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaCl固体和浓硫酸各自配制0.5mol.L-1的溶液,所用仪器完全相同 |
| B、酸式滴定管注入NaHCO3溶液之前应进行捡漏、洗涤和润洗 |
| C、过滤、溶解、蒸发操作中都需要使用玻璃棒 |
| D、用小试管和胶头滴管不能鉴别出Na2CO3溶液、稀盐酸、Ba(OH)2溶液、酚酞试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、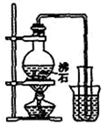 制取少量蒸馏水 |
B、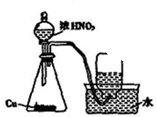 用铜和浓硝酸制取少量NO3 |
C、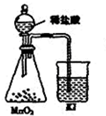 比较MnO2、Cl2、I2的氧化性 |
D、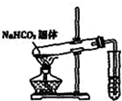 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(SO42-) |
| B、相同温度下,1 mol.L-1醋酸与0.5mol.L-1醋酸中c(H+)之比 |
| C、用同浓度盐酸中和相同体积pH均为12的Ba(OH)2和KOH,所需盐酸的体积之比 |
| D、pH=2的H2SO4溶液与pH=2的CH3COOH溶液中,c(CH3COOH):c(H2SO4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com