
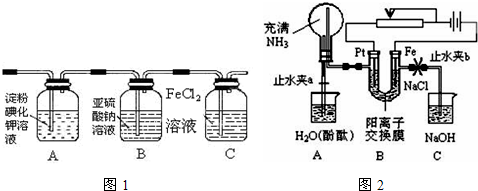
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中 滴加 |


科目:高中化学 来源: 题型:
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +2 |
| Xe |
| -2 |
| F |
| +1 |
| X |
| -1 |
| F |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
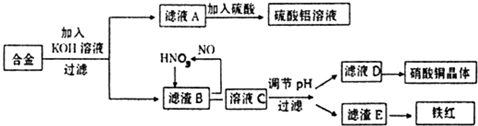
查看答案和解析>>
科目:高中化学 来源: 题型:
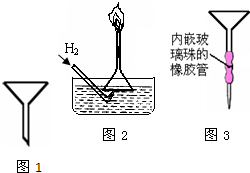 普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.
普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com