
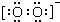 ;
;分析 (1)过氧化钠是钠的氧化物,氧氧之间形成一对共用电子对,过氧化钠中阴离子的电子式为: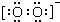 ;
;
(2)碳酸氢钠不稳定,加热易分解,发生2NaHCO3=Na2CO3+CO2↑+H2O,与过氧化钠可能发生2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2,以此解答;
(3)由流程如下:Na$\frac{180-200℃熔化}{通入无C{O}_{2}的空气}$→Na2O$\frac{300-400℃熔化}{通入无C{O}_{2}的空气}$→Na2O2
信息,可知过氧化钠在高温的条件下稳定,结合质量的变化,分析解答;
(4)由干法制备中每1mol FeSO4参加反应转移4mol电子,所以产物中的铁是+6价,而过氧化钠是氧化剂,根据得失电子守恒书写化学方程式.
解答 解:(1)过氧化钠是钠的氧化物,氧氧之间形成一对共用电子对,过氧化钠中阴离子的电子式为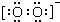 ,故答案为:
,故答案为: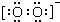 ;
;
(2)碳酸氢钠不稳定,加热易分解,发生2NaHCO3=Na2CO3+CO2↑+H2O,与过氧化钠可能发生2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2,所以一定含有碳酸钠,故答案为:Na2CO3;
(3)78克Na2O2的物质的量为:1mol,而222克质量增加222-78=144g,与水反应刚好结合8mol的H2O,所以A的物质的化学式为:Na2O2•8H2O,故答案为:Na2O2•8H2O;
(4)由干法制备中每1mol FeSO4参加反应转移4mol电子,所以产物中的铁是+6价,而过氧化钠是氧化剂,根据得失电子守恒书写化学方程式为:FeSO4+4Na2O2=Na2FeO4+2Na2O+Na2SO4+O2↑,故答案为:FeSO4+4Na2O2=Na2FeO4+2Na2O+Na2SO4+O2↑.
点评 本题考查过氧化钠与碳酸氢钠的性质及相关的化学反应,对于这类物质之间相互反应的题目,首先必须牢牢把握住物质的性质以及相互之间的反应,对于化学反应方程式应该“了如指掌”,注意把握相关物质的性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4增重的是CO2的质量 | B. | 该有机物中没有氧元素 | ||
| C. | 该有机物中有氧元素 | D. | 碱石灰增重的是CO2和H2O的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
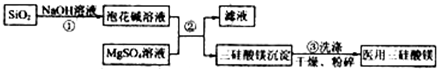
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
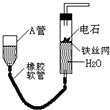 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等浓度的NaOH溶液至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol/L的盐酸溶液中加入等体积0.1 mol•L-1 NH3•H2O溶液:c(Cl-)=c(H+)+c( NH3•H2O) | |
| D. | 25℃时,0.1 mol•L-1的NaClO2溶液和0.001 mol•L-1CH3COONa溶液pH相等,则HClO2的电离平衡常数大于CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ Cl- Mg2+ SO42- | B. | K+ Cu2+ I- SO42- | ||
| C. | NO3- K+ Cl- OH- | D. | Al3+ Na+ S2- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com