
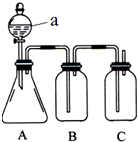
 某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液分析 比较HNO3、H2CO3、H2SiO3的酸性强弱,由实验装置可知,a为分液漏斗,a为硝酸,在A中硝酸与碳酸钠发生强酸制取弱酸的反应,B中为碳酸氢钠溶液除去挥发的硝酸,在C中二氧化碳与硅酸钠发生强酸制取弱酸的反应,以此可比较酸性,最高价氧化物的水化物酸性越强,则对应非金属的非金属性越强,以此来解答.
解答 解:由实验装置可知,a为分液漏斗,a为硝酸,在A中硝酸与碳酸钠发生强酸制取弱酸的反应,B中为碳酸氢钠溶液除去挥发的硝酸,在C中二氧化碳与硅酸钠发生强酸制取弱酸的反应,
(1)由图可知,a为分液漏斗,故答案为:分液漏斗;
(2)由上述分析可知,a中试剂为稀硝酸,故答案为:稀硝酸;
(3)B的作用为吸收气体中硝酸,且不能吸收二氧化碳,则B中试剂为饱和碳酸氢钠溶液,故答案为:饱和碳酸氢钠溶液;吸收气体中硝酸;
(4)C中试剂为硅酸钠溶液,发生离子反应为SiO32-+CO2+H2O=H2SiO3↓+CO32-,故答案为:;SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(5)由上述实验可知,酸性为硝酸>碳酸>硅酸,则非金属性N>C>Si,故答案为:N>C>Si.
点评 本题考查酸性及非金属性比较的探究实验,为高频考点,注意硝酸有挥发性,导致二氧化碳气体中含有硝酸会对实验造成干扰,侧重分析与实验能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 单位时间内消耗0.1mol X,同时生成0.2mol Y | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO溶液制备HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量相等的185Hf与180Hf质量相同 | |
| B. | 核外电子数分别为108、113 | |
| C. | 1 mol 180Hf比1 mol 185Hf的中子数少5NA | |
| D. | 180Hf、185Hf在周期表中的位置不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ④①②③ | C. | ①②③④ | D. | ④③②① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com