
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
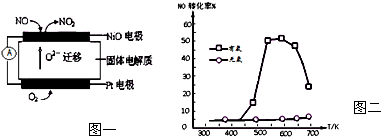
分析 (1)根据图片知,铂电极上氧气得电子作正极,NiO电极上NO失电子发生氧化反应生成NO2;
(2)根据方程式①②的加减得出化学方程式③,焓变相应的加减,从而计算出△H3;
(3)①A.催化剂对转化率无影响;
B.催化剂对转化率无影响;
C.该反应为放热反应,降低温度,平衡正移;
D.增大压强,平衡向气体体积减小的方向移动;
E.减少生成物的浓度,平衡正移;
F.由表中数据可知,[n(NO2)/n(CH4)]越大,NO2转化率越小;
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,则NO2和CH4各为0.2mol,NO2的平衡转化率为60%,利用三段式求出平衡浓度,再求平衡常数K;
③从0~5min,CO2的浓度从0逐渐增大到0.03mol/L,5min~10min,CO2的浓度保持不变,在10min时将容器的容积快速压缩为1L,CO2的浓度瞬间变为0.06mol/L,然后逐渐减小,达到平衡时,CO2平衡浓度大于0.03 mol/L;
(4)反应4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化.
解答 解:(1)负极NiO上一氧化氮失电子和氧离子反应生成二氧化氮,电极反应式为NO-2e-+O2-═NO2,
故答案为:NO+O2--2e-=NO2;
(2)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
由盖斯定律可知,方程式③=$\frac{1}{2}$(②+①)则△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$;
故答案为:$\frac{△{H}_{1}+△{H}_{2}}{2}$;
(3)①A.催化剂对转化率无影响,则增加催化剂的表面积,NO2转化率不变,故A错误;
B.催化剂对转化率无影响,改用高效催化剂,NO2转化率不变,故B错误;
C.该反应为放热反应,降低温度,平衡正移,则NO2转化率增大,故C正确;
D.增大压强,平衡向气体体积减小的方向移动,则平衡向逆方向移动,所以NO2转化率减小,故D错误;
E.减少生成物的浓度,平衡正移,所以分离出H2O(g),平衡正移,则NO2转化率增大,故E正确;
F.由表中数据可知,[n(NO2)/n(CH4)]越大,NO2转化率越小,减小[n(NO2)/n(CH4)],NO2转化率增大,故F正确;
故答案为:CEF;
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,则NO2和CH4各为0.2mol,NO2的平衡转化率为60%,
依题意得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)
c(始) mol/L:0.10 0.10 0 0 0
c(变) mol/L:0.03 0.06 0.03 0.03 0.06
c(平 )mol/L:0.07 0.04 0.03 0.03 0.06
K=$\frac{c({N}_{2})•{c}^{2}({H}_{2}O)•c(C{O}_{2})}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$=$\frac{0.03×0.0{6}^{2}×0.03}{0.07×0.0{4}^{2}}$=2.89×10-2,
答:该温度时的平衡常数2.89×10-2;
③从0~5min,CO2的浓度从0逐渐增大到0.03mol/L,5min~10min,CO2的浓度保持不变,在10min时将容器的容积快速压缩为1L,CO2的浓度瞬间变为0.06mol/L,然后逐渐减小,达到平衡时,CO2平衡浓度大于0.03 mol/L,则作图为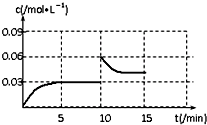 ;
;
故答案为: ;
;
(4)反应4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化,
故答案为:脱氮反应是放热反应,达到平衡后升高温度,平衡逆向移动;温度升高发生了副反应:4NH3+5O2═4NO+6H2O.
点评 本题考查了盖斯定律的应用、原电池原理及电极反应书写、化学反应速率和化学平衡的影响因素、K的计算等知识,题目难度较大,试题涉及的题量较大,知识点较多、综合性强,熟练掌握知识的迁移和应用是解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯酸钾和二氧化锰的混合物制取氧气 | |
| B. | 石灰石和盐酸制取二氧化碳 | |
| C. | 浓盐酸和二氧化锰制取氯气 | |
| D. | 铜与稀硝酸反应制取一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究金属铁及其化合物的性质有重要意义.
研究金属铁及其化合物的性质有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 用途 | 解释 |
| A | 硅胶可作袋装食品的干燥剂 | 硅胶多孔,吸收空气中氧气的能力强 |
| B | CuSO4可作游泳池的消毒剂 | 铜盐能使构成病毒的蛋白质变性 |
| C | 浸有高锰酸钾溶液的硅藻土可作某些水果的保鲜剂 | 高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| D | Na2O2可作呼吸面具中的供氧剂 | Na2O2能吸收CO2同时放出O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{y-2x}{a}$ mol/L | B. | $\frac{y-x}{a}$ mol/L | C. | $\frac{2y-2x}{a}$ mol/L | D. | $\frac{2y-4x}{a}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com